Karboksilna kiselina
Karboksilna kiselina je organsko jedinjenje koje u sebi sadrži funkcionalnu karboksilnu grupu (-COOH).[1] To je velika i raznolika grupa hemijskih jedinjenja, a drugi naziv za njih su i organske kiseline. Opšta formula svih karboksilnih kiselina je R-COOH, gde R predstavlja alkil grupu, CnH2n. Najprostije karboksilne kiseline su tzv. alkanske kiseline kod kojih je radikal alkil grupa. Soli organskih kiselina se nazivaju karboksilati.[2][3]

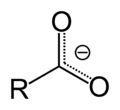

Karboksilna grupa je približno trigonalno-planarna. Izuzetak su vrlo razblaženi rastvori kada usled vodoničnog vezivanja, nastaju dimeri karboksilnih kiselina.
Karboksilne kiseline reaguju u mnogim procesima živih bića, među kojima je značajna i esterifikacija. U tom procesu karboksilne kiseline reaguju sa organskim jedinjenjima koje sadrže hidroksilnu grupu (-ОН), odnosno alkoholima. Svakako najpoznatiji estri karboksilnih (masnih) kiselina su lipidi.
Nomenklatura uredi
Karboksilne kiseline se imenuju kao alkanske kiseline, dodatkom nastavka -ska kiselina na naziv alkana. Tako na primer od metana nastaje metanska kiselina.[4] Brojem 1 se obeležava karbonilni ugljenik najdužeg niza u kome se nalazi karboksilna grupa. Dikarboksilne kiseline se imenuju kao alkan-dikiseline. Ciklični i aromatični sistemi nazivaju se cikloalkankarboksilne i benzoeve kiseline. Kod ovih sistema ugljenikovom atomu za koji je vezana karboksilna grupa pripisuje se broj 1.
Iako postoji IUPAC-ova nomenklatura, češće se koriste trivijalni nazivi. Na primer, butanoična kiselina se uglavnom naziva buterna kiselina (C3H7CO2H).
Karboksilni jon R-COO− se imenuje dodavanjem sufiksa -ate, pa od sirćetne kiseline nastaje acetatni jon.
| Broj ugljenikovih atoma | Trivijalni naziv | Ime po IUPAC-u | Strukturna formula | Mesto nalaženja ili upotreba |
|---|---|---|---|---|
| 1 | Mravlja kiselina | Metanska kiselina | HCOOH | Ubod mrava |
| 2 | Sirćetna kiselina | Etanska kiselina | CH3COOH | Sirće |
| 3 | Propionska kiselina | Propanska kiselina | CH3CH2COOH | Prezervativ |
| 4 | Buterna kiselina | Butanska kiselina | CH3(CH2)2COOH | Puter |
| 5 | Valerinska kiselina | Pentanska kiselina | CH3(CH2)3COOH | biljka Valerijana |
| 6 | Kapronska kiselina | Heksanska kiselina | CH3(CH2)4COOH | Kozja mast |
| 7 | Enantinska kiselina | Heptanska kiselina | CH3(CH2)5COOH | Miris |
| 8 | Kaprilna kiselina | Oktanska kiselina | CH3(CH2)6COOH | Kokosova palma |
| 9 | Pelargonska kiselina | Nonanska kiselina | CH3(CH2)7COOH | Biljka muškatla |
| 10 | Kaprinska kiselina | Dekanska kiselina | CH3(CH2)8COOH | Kokosovo i ulje palminih koštica |
| 11 | Undekanska kiselina | Undekanska kiselina | CH3(CH2)9COOH | Sredstvo protiv gljivica |
| 12 | Laurinska kiselina | Dodekanska kiselina | CH3(CH2)10COOH | Kokosovo ulje i sapuni za pranje ruku |
| 13 | Tridekanska kiselina | Tridekanska kiselina | CH3(CH2)11COOH | Biljni metabolit |
| 14 | Miristinska kiselina | Tetradekanska kiselina | CH3(CH2)12COOH | Muškatni oraščić |
| 15 | Pentadecilna kiselina | Pentadekanska kiselina | CH3(CH2)13COOH | Mlečna mast |
| 16 | Palmitinska kiselina | Heksadekanska kiselina | CH3(CH2)14COOH | Palmino ulje |
| 17 | Margarinska kiselina | Heptadekanska kiselina | CH3(CH2)15COOH | Feromoni raznih životinja |
| 18 | Stearinska kiselina | Oktadekanska kiselina | CH3(CH2)16COOH | Čokolada, masti, sapuni i ulja |
| 19 | Nonadesilna kiselina | Nonadekanska kiselina | CH3(CH2)17COOH | Masti, biljna ulja, feromoni |
| 20 | Arahidinska kiselina | Ikosanoinska kiselina | CH3(CH2)18COOH | Ulje od kikirikija |
| Klasa jedinjenja | Članovi |
|---|---|
| nezasićene monokarboksilne kiseline | akrilna kiselina (2-propenska kiselina) – CH2=CHCOOH, koristi se u sintezi polimera |
| Masne kiseline | zasićene i nezasićene monokarboksilne kiseline sa srednjim do dugim lancem, sa parnim brojem ugljenika; primeri: dokozaheksaenoinska kiselina i eikozapentaenoinska kiselina (prehrambeni suplementi) |
| Aminokiseline | gradivni blokovi proteina |
| Keto kiseline | kiseline sa biohemijskim značajem koje sadrže ketonske grupe; primeri: acetosirćetna kiselina i piruvinska kiselina |
| Aromatične karboksilne kiseline | sadrže najmanje jedan aromatični prsten; primeri: benzojeva kiselina - natrijumova so benzojeve kiseline se koristi kao konzervans za hranu, salicilna kiselina - beta-hidroksilni tip koji se nalazi u mnogim proizvodima za negu kože, fenil alkanske kiseline - klasa jedinjenja gde je fenil grupa vezana za karboksilne kiseline |
| Dikarboksilne kiseline | sadrže dve karboksilne grupe; primeri: monomer adipinske kiseline koji se koristi za proizvodnju najlona i aldarne kiseline – familija šećernih kiselina |
| Trikarboksilne kiseline | sadrže tri karboksilne grupe; primeri: limunska kiselina – prisutna u citrusnom voću i izolimunska kiselina |
| Alfa hidroksilne kiseline | sadrže hidroksilnu grupu na prvoj poziciji; primeri: glicerinska kiselina, glikolna kiselina i mlečna kiselina (2-hidroksipropanska kiselina) – prisutna u kiselom mleku, vinska kiselina – prisutna u vinu |
| Beta hidroksilne kiseline | sadrže hidroksilnu grupu na drugoj poziciji |
| Omega hidroksilne kiseline | sadrže hidroksilnu grupu izvan prve i druge pozicije |
| Diviniletarske masne kiseline | sadrže dvostruko nezasićeni ugljenični lanac vezan etarskom vezom za masnu kiselinu. Ove kiseline su prisutne u nekim biljkama |
Fizička svojstva uredi
Rastvorljivost uredi
Karboksilne kiseline su polarne. Budući da su one akceptori vodonične veze (karbonil –C=O) i donori vodonične veze (hidroksil –OH), one takođe učestvuju u vodoničnom vezivanju. Zajedno, hidroksilna i karbonilna grupa tvore funkcionalnu karboksilnu grupu. Karboksilne kiseline obično postoje kao dimeri u nepolarnim medijima zbog njihove sklonosti da se „samoasociraju”. Lakše karboksilne kiseline (1 do 5 ugljenika) su rastvorljive u vodi, dok teže karboksilne kiseline imaju ograničenu rastvorljivost zbog povećane hidrofobne prirode alkilnog lanca. Ove kiseline dužeg lanca imaju tendenciju da budu rastvorljive u manje polarnim rastvaračima kao što su etri i alkoholi.[5] Vodeni natrijum hidroksid i karboksilne kiseline, čak i hidrofobne, reaguju dajući natrijumove soli rastvorljive u vodi. Na primer, heptanska kiselina ima nisku rastvorljivost u vodi (0,2 g/L), ali je njena natrijumova so veoma rastvorljiva u vodi.
Tačke ključanja uredi
Karboksilne kiseline imaju tendenciju da imaju veće tačke ključanja od vode, zbog veće površine i sklonosti stvaranja stabilizovanih dimera putem vodoničnih veza. Da bi došlo do ključanja, bilo se veze dimera moraju prekinuti ili ceo dimerizovani aranžman mora ispariti, čime se značajno povećava neophona entalpija isparavanja.
Kiselost uredi
Karboksilne kiseline su Brensted-Laurijeve kiseline, jer su donatori protona (H+). One su najčešći tip organske kiseline.
Karboksilne kiseline su tipično slabe kiseline, što znači da se samo delimično disociraju na H3O+ katjone i RCOO− anjone u neutralnom vodenom rastvoru. Na primer, na sobnoj temperaturi, u 1-molarnom rastvoru sirćetne kiseline, disocira se samo 0,4% kiseline. Supstituenti koji povlače elektrone, poput -CF3 grupe, daju jače kiseline (pKa mravlje kiseline je 3,75, dok trifluorosirćetna kiselina, sa trifluorometil supstituentom, ima pKa 0,23). Supstituenti koji doniraju elektrone daju slabije kiseline (pKa mravlje kiseline je 3,75, dok sirćetna kiselina, sa metil supstituentom, ima pKa 4,76)
| Karboksilna kiselina[6] | pKa |
|---|---|
| Sirćetna kiselina (CH3CO2H) | 4,76 |
| Benzojeva kiselina (C6H5CO2H) | 4,2 |
| Mravlja kiselina (HCOOH) | 3,75 |
| Hlorosirćetna kiselina (CH2ClCO2H) | 2,86 |
| Dihloroasirćetna kiselina (CHCl2CO2H) | 1,29 |
| Oksalna kiselina (HO2CCO2H)
(prva disocijacija) |
1,27 |
| Oksalna kiselina (HO2CCO2−)
(druga disocijacija) |
4,14 |
| Trihlorosirćetna kiselina (CCl3CO2H) | 0,65 |
| Trifluorosirćetna kiselina (CF3CO2H) | 0,23 |
Deprotonizacija karboksilnih kiselina daje karboksilatne anione; oni su rezonantno stabilizovani, jer se negativni naboj delokalizuje preko dva atoma kiseonika, povećavajući stabilnost aniona. Svaka od veza ugljenik-kiseonik u karboksilatnom anjonu ima parcijalni karakter dvostruke veze. Parcijalni pozitivni naboj karbonilnog ugljenika takođe je oslabljen -1/2 negativnim naelektrisanjem na 2 atoma kiseonika.
Miris uredi
Karboksilne kiseline često imaju jake kisele mirise. Estri karboksilnih kiselina imaju ugodan miris, a mnogi se koriste u parfemima.
Karakterizacija uredi
Karboksilne kiseline se lako identifikuju kao takve infracrvenom spektroskopijom. One pokazuju oštar pojas povezan sa vibracijom C–O vibracione veze (νC=O) između 1680 i 1725 cm−1. Karakteristična νO–H traka pojavljuje se kao široki vrh u regionu od 2500 do 3000 cm−1.[5] Pomoću 1H NMR spektrometrije, hidroksilni vodonik se pojavljuje u regionu 10–13 ppm, iako je često proširen ili se ne primećuje zbog razmene sa tragovima vode.
Pojava i primene uredi
Mnoge karboksilne kiseline se industrijski proizvode u velikim količinama. Takođe se često nalaze u prirodi. Estri masnih kiselina su glavne komponente lipida, a poliamidi aminokarboksilnih kiselina su glavne komponente proteina.
Karboksilne kiseline se koriste u proizvodnji polimera, farmaceutskih proizvoda, rastvarača i aditiva za hranu. Industrijski važne karboksilne kiseline uključuju sirćetnu kiselinu (komponenta sirćeta, prekurzor rastvarača i premaza), akrilnu i metakrilnu kiselinu (prekursori polimera, lepkova), adipinsku kiselinu (polimeri), limunsku kiselinu (aroma i konzervans u hrani i pićima), etilendiamintetrasirćetna kiselina (helirajući agens), masne kiseline (prevlake), maleinska kiselina (polimeri), propionska kiselina (konzervans za hranu), tereftalna kiselina (polimeri). Važne soli karboksilata su sapuni.
Sinteza uredi
Industrijske rute uredi
Generalno, industrijski putevi do karboksilnih kiselina razlikuju se od onih koji se koriste u manjem obimu, jer zahtevaju specijalizovanu opremu.
- Karbonilacija alkohola kako je ilustrovano Kativa procesom za proizvodnju sirćetne kiseline. Mravlja kiselina se dobija različitim putem karbonilacije, takođe počevši od metanola.
- Oksidacija aldehida vazduhom pomoću katalizatora kobalta i mangana. Potrebni aldehidi se lako dobijaju iz alkena hidroformilacijom.
- Oksidacija ugljovodonika vazduhom. Za jednostavne alkane, ova metoda je jeftina, ali nije dovoljno selektivna da bi bila korisna. Alilna i benzilna jedinjenja podležu selektivnijoj oksidaciji. Alkilne grupe na benzenskom prstenu oksidiraju se u karboksilnu kiselinu, bez obzira na dužinu njenog lanca. Benzojeva kiselina iz toluena, tereftalna kiselina iz para-ksilena i ftalna kiselina iz orto-ksilena su ilustrativni primeri konverzije na velikim skalama. Akrilna kiselina nastaje iz propena.[7]
- Oksidacija etena pomoću katalizatora silikovolframske kiseline.
- Dehidrogenizacija alkohola katalizovana bazom.
- Karbonilacija povezana sa dodatkom vode. Ova metoda je efikasna i svestrana za alkene koji stvaraju sekundarne i tercijarne karbokatjone, npr. izobutilena do pivalinske kiseline. U Košovoj reakciji, dodavanje vode i ugljen-monoksida u alkene katalizuju jake kiseline. Hidrokarboksilacije uključuju istovremeni dodatak vode i CO. Takve reakcije se ponekad nazivaju „Repeova hemija”.
- HCCH + CO + H2O → CH2=CHCO2H
- Hidroliza triglicerida dobijenih iz biljnih ili životinjskih ulja. Ove metode sinteze nekih dugolančanih karboksilnih kiselina povezane su sa proizvodnjom sapuna.
- Fermentacija etanola. Ova metoda se koristi u proizvodnji sirćeta.
- Kolbe–Šmitova reakcija obezbeđuje put do salicilne kiseline, preteče do aspirina.
Laboratorijske metode uredi
Pripremne metode za reakcije malih razmera za istraživanje ili proizvodnju finih hemikalija često koriste skupe potrošne reagense.
- Oksidacija primarnih alkohola ili aldehida jakim oksidantima kao što su kalijum-dihromat, Jonesov reagens, kalijum-permanganat ili natrijum-hlorit.
- Oksidativno cepanje olefina ozonolizom, kalijum permanganatom ili kalijum dihromatom.
- Hidroliza nitrila, estara ili amida, obično sa kiselom ili baznom katalizom.
- Karbonizacija Grinjarovog reagensa i organolitijumskih reagensa:
- RLi + CO2 → RCO2Li
- RCO2Li + HCl → RCO2H + LiCl
- Halogenizacija praćena hidrolizom metil ketona u reakciji haloforma
- Bazno katalizovano cepanje neenolizabilnih ketona, posebno aril ketona:[8]
- RC(O)Ar + H2O → RCO2H + ArH
Reference uredi
- ^ IUPAC. „carboxylic acids”. Kompendijum hemijske terminologije (Internet izdanje).
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I izd.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th izd.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
- ^ IUPAC, Plava knjiga, http://www.acdlabs.com/iupac/nomenclature/93/r93_480.htm
- ^ a b Morrison, R.T.; Boyd, R.N. (1992). Organic Chemistry (6th izd.). ISBN 0-13-643669-2.
- ^ Haynes, William M., ur. (2011). CRC Handbook of Chemistry and Physics (92nd izd.). CRC Press. str. 5–94 to 5–98. ISBN 978-1439855119.
- ^ Riemenschneider, Wilhelm (2002). „Carboxylic Acids, Aliphatic”. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. ISBN 3527306730. doi:10.1002/14356007.a05_235..
- ^ Perry C. Reeves (1977). „Carboxylation Of Aromatic Compounds: Ferrocenecarboxylic Acid”. Org. Synth. 56: 28. doi:10.15227/orgsyn.056.0028.
Spoljašnje veze uredi
- Carboxylic acids synthesis — Collection of links pertaining to synthesis of Carboxylic acid
- Carboxylic acids pH and titration — freeware for calculations, data analysis, simulation, and distribution diagram generation