Лангерхансова острвца
Лангерхансова острвца су подручја панкреаса (гуштераче) која садрже ендокрине ћелије (које производе хормоне панкреасе) груписане у облику острваца разбацаних по егзокрином панкреасу, распоређенених између његових мешкова (највише у репу панкреаса). Откривена су 1869. од стране немачког патолога и анатома Пола Лангерханса по коме су и добила име.[1]
| Лангерхансова острвца | |
|---|---|
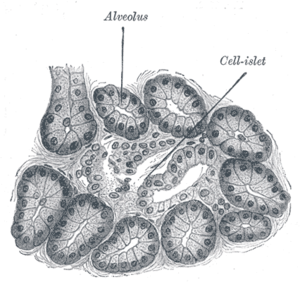 | |
| Грејова анатомија: Лангерхансова острвца (панкреас пса) | |
| Класификација и спољашњи ресурси |
Физиологија уреди
- Егзокрина функција
Панкреас је жлезда са егзокриним лучењем ензима који играју виталну улогу у:
- неутрализацији киселине која из желуца доспева у дуоденум, чиме се спречава оштећења слузокоже дуоденума и црева,
- процесу разбијања макромолекуларних хранљиве материје - протеине, масти и скроба - у мање честице које могу да се апсорбује преко слузокоже црева у крв.
- Ендокрина функција
Поред тога што је егзокрина жлезда, панкреас је и ендокрина жлезда која лучи важне хормоне - инсулин и глукагона- који играју виталну улогу у метаболизму липида и угљених хидрата. Ови хормони су у организму неопходни за одржавање нормалног нивоа концентрације глукозе у крви.
Хистологија уреди
Панкреас је подељен у режњеве преградама које се састоје од везивног ткива. Режњеви се састоје углавном од гроздастих структура егзокриних ћелија које се зову ацинуси и које луче дигестивне ензиме. Егзокрини секрет из ацинуса се сукцесивно креће кроз интеркаларне и интралобуларне канале, нтерлобуларне цеви да би коначно кроз главни панкреасни канала доспео у дуоденум.[2]
По целом ткиву егзокриног панкреаса распоређена су Лангерхансова острвца, ендокрина компонента панкреаса. Острвца садрже више типова ћелија (алфа, бета и делта) богато васкуларизованих, што омогућаваја добар и брз унос хормона у циркулацију. Иако Лангерхансова острвца чине око 1 до 2% масе панкреаса, 10 до 15% протока крви панкреаса обавља се у острвцима. Код здраве одрасле особе у његовом панкреасу постоји око милион острваца, чија је појединачна маса од 1 до 1,5 грам.[3] Лангерхансова острвца су разбацана по егзокрином панкреасу и смештена су између његових мешкова, највише у репу панкреаса. У стандардном хистолошком препарату делова панкреаса, острвца се приказују као релативно бледо обојене групе ћелија уграђен у мору тамније обојеног егзокриног ткива. Слика са десне стране приказује острвца у панкреасном ткиву. Панкреасна острва састоје се из више врста ћелија, од којих свака производи другачије ендокрине производе:[3]
| Врста ћелија | Скрачени назив | Функција |
|---|---|---|
| Алфа ћелије | α-ћелија | Луче хормон глукагона. Оне чине 15% до 20% од укупног броја ћелија острваца. |
| Бета ћелије | β-ћелије | Луче инсулин и најзаступљеније су ћелије у острвцима. Оне чине 65% до 80% од укупног броја ћелија острваца. |
| Делта ћелије | δ-ћелија | Луче хормон соматостатин. Оне чине 3% до 10% од укупног броја ћелија острваца. |
| ПП ћелије | F ћелије | Луче панкреасне полипептиде. Оне чине 3% до 5% од укупног броја ћелија острваца. |
| Епсилон ћелије | ξ-ћелија | Луче грелин (недавно откривен пептидни хормон, који поседује особине гонадотропина и хормона других метаболичких и ендокриних функција. Оне чине мање од 1% од укупног броја ћелија острваца. |
Интересантно је да се различити типови ћелија унутар острваца различито распоређују - бета ћелије заузимају централни део острвца и окружени су „кором“ алфа и делта ћелије. Осим инсулина, глукагона и соматостатина, низ других „мање значајних“ хормона који су идентификовани као производ Лангхансових ћелија.
Лангерхансова острвца су инервисана од стране парасимпатичког и симпатијчког неурона, преко којих се нервни сигнали, јасно модулирани, регулишу лучење инсулина и глукагона.
Ендокрина функција Лангерхансових острваца уреди
Лангерхансова острвца су одговорна за ендокрину функцију која се огледа у раду ендокриних ћелија груписаних у овим острвцима. Лангерхансова острвца се сатоје из три типа ћелија: алфа, бета и делта. Бета ћелије излучују хормон инсулин (лат. insula - острво), док алфа ћелије излучују глукагон. Инсулин и глукагон поседују антагонистичка дејства: док инсулин смањује концентрацију глукозе у крви, глукагон је повећава. Делта ћелије луче хормон соматостатин који ихибира секрецију осталих хормона. Такође панкреас секретује још један хормон амилин, који регулише брзину ресорпције у гастроинтестиналоом систему.
Повећана концентрација глукозе (шећера) у крви доводи до појачаног лучења инсулина под чијим дејством се смањује ниво шећера у крви. Када се ниво глукозе смањи на нормалу, смањује се и лучење инсулина. Међутим, када се инсулин недовољно излучује или постоји резистенција на њега долази до нагомилавања глукозе у крви, тј. хипергликемије (вредности веће од 6,66 mmol/l) што доводи до шећерне болести (лат. diabetes mellitus)
Паракрина повратна спрега уреди
Паракрини систем повратне спреге информација у Лангерхансовим острвцима има следећу улогу:[4]
- Инсулин: активира бета ћелије и спречава лучење алфа ћелија
- Глукагон:активира алфа ћелије које затим активирају бета ћелије и делта ћелије. Глукагон се сматра антагоснистичким хормоном инсулину. Повећање лучења глукагона је праћено падом лучења инсулина и обрнуто.
- Соматостатин: инхибира алфа и бета ћелије и инхибише лучење инсулина и глукагона.
-
Острво миша имуно обојено на полипептид панкреаса
-
Острво миша имуно обојено на инсулин
-
Острво миша имуно обојено на глукагон
Одржавање равнотеже између инсулина и гликозе је веома прецизно. Само несметано функционисање паракрине повратне везе обезбеђује одржавање енергетске равнотеже и правилну исхрањеност организма.
Према најсавременијим сазнањима о главном инкретину-хормону – GLP-1, посебно је значајна улога овог хормона у регулацији секреције инсулина, преко дејства на бета и алфа ћелије панкреаса. Најпотентнији глукоинкретин-хормон, GLP-, стимулише секрецију инсулина зависну од нивоа гликозе и при еугликемији, односно GLP-1 игра главну улогу у ентероинсулинској осовини. Дејство GLP-1 на ћелије D и бета-ћелије непосредно је, док је дејство на алфа-ћелије посредно, односно GLP-1 инхибише лучење глукагона паракриним механизмом путем стимулације лучења соматостатина.[5]
Познато је да GLP-1 „дозвољава“, у активацији гликозе, да се повећа секреција инсулина из бета ћелија, односно GLP-1 може „опремити“ бета ћелије да буду гликозно компетентне.
Он такође стимулише биосинтезу проинсулина (транскрипцију гена за инсулин), стимулише секрецију инсулина, а најновија истраживања указују да стимулише пролиферацију и неогенезу бета ћелија ендокриног панкреаса.
Такође он стимулише лучење соматостатина, а на алфа ћелије панкреаса делује тако што инхибише секрецију глукагона. Међутим, нејасно је да ли GLP-1 инхибише секрецију глукагона непосредним дејством на алфа ћелије или познатим паракриним ефектима инхибиције инсулина и соматостатина на алфа ћелије.
Трансплантација панкреаса у лечењу дијабетеса уреди
Трансплантација панкреаса је оптимални облик савремене супституционе терапије дијабетеса типа 1 којим би могла да се постигне инсулинске независност болесника. Према препорукама Америчке асоцијације за дијабетес трансплантација ендокриног панкреаса је прихваћена као терапијска метода, која има за циљ да: поправи квалитет живота болесника са дијабетесом, елиминише потребу за давањем инсулина и честим контролама гликемија, елиминише акутне компликације као и да спречава појаву или успори напредовање касних компликација дијабетеса.[6] Трансплантација ендокриног панкреаса се може извршити;[7]
- Трансплантацијом целог панкреаса
Прва трансплантација људског панкреаса у циљу лечења пацијената са дијабетесом тип 1 извршена је 1966. у Минесоти, САД. Према подацима Интернационалног Регистра за трансплантацију панкреаса до сада је обављено око 20.000 трансплантација. Једногодишња потпуна независност од примене инсулина уз нормалну јутарњу гликемију и нормалне или само благо повишене вредности гликозилираног хемоглобина (ХбА1ц), забележена је код 80% пацијената код којих је панкреас истовремено трансплантиран са бубрегом.
- Трансплантација сегмената или хуманих адултних острваца ендокриног панкреаса
Ослобађање очуваних острваца панкреаса од његовог околног ткива врши се ензимском дигестијом применом колагеназе. Изолација хуманих адултних острваца врши се: неаутоматским или аутоматским методом. За постизање инсулинске независности неопходна је трансплантација око 500.000 острваца, која се пресађују преко вена јетре. Након пресађивања неопходна је имуносупресивна терапија. Инсулинска независност се постиже у око 32% пацијената, а преживљавање трансплантираних изолованих острваца и инсулинска независност трајала је у просеку 6 година.[8]
- Трансплантацијом изолованих феталних или адултних острваца ендокриног панкреаса
Ову врсту трансплантације карактерише примена феталног ендокриног панкреаса или ендокриног дела феталног панкреаса који има способност за даљи раст и развој. Преостали део панкреаса подлеже разградњи у току припреме и након трансплантације.
Ова методу карактерише мала запремина трансплантираног ткива, једноставност примене уз минималну хируршку интервенцију.
Доступност феталног ткива је нажалост ограничена и захтева поштовање строгих етичких правила. Инсулинска независност након примене хуманих феталних острваца није забележена, али је постигнут значајно смањења дозе инсулина (за око 30%) уз стабилну контролу нивоа гликемије (у трајању од око 6 месеци) и успоравање напредовања промена на крвним судовима оку, срцу, бубрегу и неравима.[9]
Док се трансплантација целог панкреаса показала као веома ефикасна у одржавању еугликемије она је повезана са значајним ризиком од оперативних и постоперативних компликација. Трансплантација острваца је атрактивнија као мање инвазивна алтернатива у односу на трансплантацијеу целог панкреаса и има перспективу у будућност ако се изврши имуносупресија применом предтрансплантационе културе. Трансплантацијом острваца међутим, не може се увек постићи одржив ниво глукозе у крви и потпуна контроле неопходне за смањење ризика од секундарних компликација дијабетеса а пацијент се излаже негативним ефектима имуносупресије. Иако је напредак недавних истраживања довело до увећања стопе инсулинске независност после трансплантације острваца, даљим развојем истраживања потребно је да се побољша дугорочна одрживост и функција острваца и задржи побољшана контрола глукозе током времена.[10]
Види још уреди
Извори уреди
- ^ Langerhans P (1869). „Beitrage zur mikroscopischen anatomie der bauchspeichel druse.”. Inaugural-dissertation. Berlin: Gustav Lange.
- ^ (језик: енглески)Р. Бовен Хистологија панкреаса colostate.edu, Приступљено 10. 4. 2013.
- ^ а б Elayat AA, el-Naggar MM, Tahir M (1995). „An immunocytochemical and morphometric study of the rat pancreatic islets”. Journal of Anatomy. 186 (Pt 3): 629—37. PMC 1167020 . PMID 7559135.
- ^ Wang, Michael B.; Bullock, John; Boyle, Joseph R. (2001). Physiology. Hagerstown, MD: Lippincott Williams & Wilkins. стр. 391. ISBN 978-0-683-30603-3.
- ^ Ding WG,; Renstrom E,; Rorsman P,; Buschard K,; Gromada J. (1997). „Glucagon like peptide 1 and glucose-dependent insulinotropic polypeptide stimulate Ca2+ induced secretion in rat alpha-cells by a protein kinase A mediated mechanism.”. Diabetes. 46: 792—800..
- ^ Hogan A, Pileggi A, Ricordi C (2008). „Transplantation: current developments and future directions; the future of clinical islet transplantation as a cure for diabetes”. Frontiers of Bioscience. 13: 1192—205. PMID 17981623. doi:10.2741/2755.
- ^ Type 1 cures - pancreas transplants, Приступљено 10. 4. 2013.
- ^ Chatenoud L (2008). „Chemical immunosuppression in islet transplantation--friend or foe?”. New England Journal of Medicine. 358 (11): 1192—3. ISSN 0028-4793. PMID 18337609. doi:10.1056/NEJMcibr0708067.
- ^ Pileggi A, Cobianchi L, Inverardi L, Ricordi C (2006). „Overcoming the challenges now limiting islet transplantation: a sequential, integrated approach”. Annals of the New York Academy of Sciences. 1079: 383—98. ISSN 0077-8923. PMID 17130583. doi:10.1196/annals.1375.059.
- ^ Meloche RM (2007). „Transplantation for the treatment of type 1 diabetes”. World Journal of Gastroenterology. 13 (47): 6347—55. PMID 18081223. doi:10.3748/wjg.13.6347.
Литература уреди
- Weyer C, Bogardus C, Mott DM, Pratley RE: The natural history of insulin secretory dysfunction and insulin resistance in the pathogenesis of type 2 diabetes mellitus. J Clin Invest104 :787 –794,1999
- Kjos SL, Peters RK, Xiang A, Henry OA, Montoro MN, Buchanan TA: Predicting future diabetes in Latino women with gestational diabetes: utility of early postpartum glucose tolerance testing. Diabetes44 :586 –591,1995
- Xiang AH, Peters RK, Trigo E, Kjos SL, Lee WP, Buchanan TA: Multiple metabolic defects during late pregnancy in women at high risk for type 2 diabetes mellitus. Diabetes48 :848 –854,1999
- Buchanan TA, Xiang AH, Kjos SL, Trigo E, Lee WP, Peters RK: Antepartum predictors of the development of type 2 diabetes in Latino women 11–26 months after pregnancies complicated by gestational diabetes. Diabetes48 :2430 –2436,1999
- The Expert Committee on the Diagnosis and Classification of Diabetes Mellitus: Report of the Expert Committee on the Diagnosis and Classification of Diabetes Mellitus. Diabetes Care20 :1183 –1197,1997
- Martin BC, Warram JH, Krolewski AS, Bergman RN, Soeldner JS, Kahn CR: Role of glucose and insulin resistance in development of type 2 diabetes mellitus: results of a 25-year follow-up study. Lancet340 :925 –929,1992
- Peters RK, Kjos SL, Xiang A, Buchanan TA: Long-term diabetogenic effect of a single pregnancy in women with prior gestational diabetes mellitus. Lancet347 :227 –230,1996
Спољашње везе уреди
- "THE ISLETS OF LANGERHANS", Karolinska Institutet, Sweden
- "Islets" међународни часопис за клиничка и експериментална истраживања физиологије и патологије Лангерхансових острваца и сродних тема
- „Islet Society“ Независна оганизација за промоцију основних и примењених истраживања Лангерхансових острваца, у контексту дијабетеса.
- Pancreas, human - H&E Архивирано на сајту Wayback Machine (29. септембар 2009), Blue Histology - Accessory Digestive Glands, School of Anatomy and Human Biology, The University of Western Australia
- Bionet škola
- Basislehrbuch Innere Medizin, H.Renz-Polster, S. Krauzig, J.Braun, Urban und Fischer (језик: немачки)
- Pathology outlines, „Панкреас“ (језик: енглески)
- Colostate, „Панкреас“
| Молимо Вас, обратите пажњу на важно упозорење у вези са темама из области медицине (здравља). |