Bioekvivalentnost
Bioekvivalentnost je farmakokinetički termin koji se koristi za poređenje očekivane biološke in vivo ekvivalencije lekova različitih proivođača. Ako su proizvodi bioekvivalentni oni moraju da budu identični u svakom pogledu.
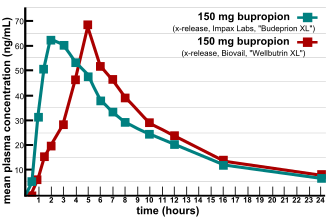
Birket je 2003. definisao bioekvivalenciju na sledeći način, „dva farmaceutska proizvoda su bioekvivalentna ako su farmaceutski ekvivalentna i njihove bioraspoloživosti (brzine i stepeni dostupnosti) nakon administracije u istoj molarnoj dozi su slične u toj meri da se može očekivati da je njihovo dejstvo, u pogledu efikasnosti i bezbednosti, esencijalno isto. Farmaceutska ekvivalencija podrazumeva istu količinu iste aktivne supstance u datom obliku doziranja, pri istom načinu administracije i zadovoljavanja istih ili uporedivih standarda.“[1]
FDA definiše bioekvivalenciju kao, „odsustvo znatnih razlika u brzini i meri u kojoj aktivni ingredijent ili aktivni sastojak u farmaceutskim ekvivalentima ili farmaceutskim alternativama postaje dostupan na mestu dejstva leka kad se administira u istoj molarnoj dozi pod sličnim uslovima u podesno dizajniranoj studiji.“[2]
Reference уреди
- ^ Birkett DJ (2003). „Generics - equal or not?” (PDF). Aust Prescr. 26: 85—7. Архивирано из оригинала (PDF) 26. 06. 2012. г. Приступљено 21. 10. 2013.
- ^ Center for Drug Evaluation and Research (2003). „Guidance for Industry: Bioavailability and Bioequivalence Studies for Orally Administered Drug Products — General Considerations” (PDF). United States Food and Drug Administration.
Literatura уреди
- Hussain AS, et al. The Biopharmaceutics Classification System: Highlights of the FDA's Draft Guidance Office of Pharmaceutical Science, Center for Drug Evaluation and Research, Food and Drug Administration.
- Mills D (2005). Regulatory Agencies Do Not Require Clinical Trials To Be Expensive International Biopharmaceutical Association: IBPA Publications.
- FDA CDER Office of Generic Drugs - further U.S. information on bioequivalence testing and generic drugs