Алфа честица
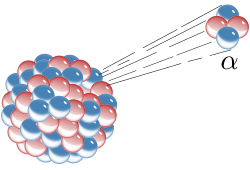
Алфа честица је честица која се састоји од два протона и два неутрона. Од језгра хелијума се разликује само својом великом брзином кретања. Најчешћа кинетичка енергија алфа-честице је 5 MeV, односно брзина 15 000 km/s. Означава се He2+ или 24He2+. Укупан спин алфа-честице је нула, па је она бозон.
 | |
| Композиција | 2 протона, 2 неутронс |
|---|---|
| Статистике | Бозонски |
| Симбол | α, α2+, He2+ |
| Маса | 6,644657230(82)×10−27 кг[1] 4,001506179127(63) у 3,727379378(23) ГеВ/ц2 |
| Наелектрисање | 2 е |
| Спин | 0[2] |






1. Језгро
2. Зона зрачења
3. Зона конвекције
4. Фотосфера
5. Хромосфера
6. Корона
7. Сунчеве пеге
8. Грануле
9. Протуберанце
Природно настаје алфа распадом радиоактивних атомских језгара. Кинетичка енергија (брзина кретања) алфа-честице зависи од атомског језгра из којег је емитована па је, на пример, досег алфа-честице емитоване из бизмута-283, у ваздуху при нормалном притиску и собној температури, 4,7 цм, а из полонијума-218 је 8,5 цм.[3] Струја алфа-честица (алфа-зрачење) врло брзо губи кинетичку енергију због јаког јонизујућег деловања и не продире дубоко у материју (зауставља је обичан лист папира).
Маса алфа честице је 6,644656 × 10-27 kg, што одговара анихилацијској енергији од 3,72738 GeV. Алфа-честице се шире брзином од око 1/20 брзине светлости, што је довољно споро да могу релативно дуго међуделовати са материјом. Зато имају јако јонизујуће деловање. Због своје ће се величине брзо сударити с неким од атома и изгубити енергију, па им је досег мали (неколико цм), а зауставља их већ кожа или комад папира. Ако се унесу у тело храном или удисањем, могу бити опасне због свог јаког јонизујућег деловања.[4]
Извори алфа-честица уреди
Алфа распад уреди
Алфа распад је претварање једног атомског језгра у друго уз зрачење алфа-честица. Језгро се трансформише (или „распада”) на мање језгро масеног броја мањег за 4 и атомског броја мањег за 2 и на алфа-честицу. Према закону помицања атоми радиоактивних елемената који емитују алфа-честице прелазе у атоме, чија је атомска маса мања за 4 атомске јединице, а атомски број мањи за 2, тј. прелазе у атоме елемената, који у периодном систему елемената заузимају положај померен за два места улево. На пример:[5]
- 238У → 234Тх + α
Већина хелијума на Земљи (око 99%) је продукат алфа распада уранијума и торијума. До распада долази због нестабилности атомског језгра, односно неуравнотеженога броја протона и неутрона у њему. Нека су атомска језгра природно нестабилна и распадају се у дужем или краћем временском интервалу (време полураспада), а нека стабилна атомска језгра могу постати нестабилне након што на њих делују честице велике енергије.
Алфа распад се догађа најчешће код масивних језгара која имају превелик однос протона у односу на неутроне. Алфа честица с два протона и два неутрона је врло стабилна конфигурација нуклеона. Многа се језгра масивнија од олова (> 106 у или више од 106 атомских јединица масе) распадају овим распадом. Најмање атомско језгро која може зрачити алфа-честице је телур (З = 52), који има атомску масу од 106 до 110. Код алфа распада атомска маса и редни бројеви језгра се мењају, што значи да атомско језгро која се распада и језгра настала тим распадом припадају различитим хемијским елементима, те стога, имају различита хемијска својства.
Кад је однос неутрона и протона у атомском језгру одређених атома пренизак, они емитују алфа-честицу како би успоставили равнотежу. На пример: полонијум-210 има 126 неутрона и 84 протона што је однос од 1,50 напрема 1. Након радиоактивног распада емитовањем алфа-честице, однос постаје 124 неутрона напрема 82 протона или 1,51 напрема 1. Будући да број протона у језгру одређује елемент, полонијум-210 након емисије алфа честице постаје олово-206 који је стабилан елемент.
Атоми који емитују алфа-честице углавном су врло велики атоми, тј. имају високе атомске бројеве. Много је природних и вештачких радиоактивних елемената који емитују алфа-честице. Природни извори алфа-честица имају атомски број најмање 82, уз неке изузетке. Најважнији алфа емитери су: америцијум-241 (З = 95), плутонијум-236 (З = 94), уранијум-238 (З = 92), торијум-232 (З = 90), радијум-226 (З = 88), радон-222 (З = 86). Алфа емитери су присутни у различитим количинама у готово свим стенама, тлу и води. Након емисије, алфа честице се због велике масе и електричног набоја крећу релативно споро (отприлике 1/20 брзине светлости) и у ваздуху потроше сву енергију након неколико центиметара и тада да вежу слободне електроне и постају хелијум.[6]
Брзина и енергија алфа-честица уреди
У погледу почетне брзине алфа-честица, енергије, домета, апсорпције и продорности кроз разне материје, као и способност за јонизацију гасова, утврђено је да оне имају своје посебне особине, које зависе од природе радиоактивног елемента из којег потичу. Почетна брзина алфа-честица је различита за различите радиоактивне елементе и износи од 14 000 до 22 000 km/s, што је око 5 до 7,5% брзине светлости.
Енергија алфа-честица зависи од природе радиоактивног елемента из којег потиче и креће се од 4 до 10 MeV. Испочетка се сматрало да све алфа-честице, које емитују радиоактивни елементи, имају исту брзину, али су онда експерименти показали да један радиоактивни изотоп може зрачити алфа-честице различитих брзина или различитих кинетичких енергија. Тако је познато да радијум-226 зрачи алфа-честице са 4 енергетске групе: 7,68 MeV, 8,277 MeV, 9,066 MeV и 10,505 MeV.
Домет и апсорпција алфа-честица уреди
Ханс Гајгер је емпиријским путем утврдио зависност домета алфа-честица, под стандардним притиском и температуром, од њихове почетне брзине. Такође је Гајгер, заједно с Џоном Нуталом, пронашао везу између времена полураспада, односно константе распадања λ, неког радиоактивног елемента који зрачи алфа-честице и њиховог домета у ваздуху, што се назива Гајгер-Наталов закон:
где је: λ - константа распадања (λ = лн 2/време полураспада), Z – атомски број, E – укупна кинетичка енергија (алфа-честице и атомског језгра из кога је настала), те а1 и а2 - константе.
С обзиром на време полураспада радиоактивних елемената, утврђено је да нестабилни атоми с кратким животом зраче алфа-честице велике енергије, велике брзине и великог домета. Домет алфа-честице се креће од 28 мм (торијум-232, време полураспада 1,39 x 1010 година) до 86 мм (полонијум-212, време полураспада 3 x 10-7 секунди).
Ни све алфа-честице једног истог радиоактивног елемента немају исти домет. Генерално, од укупног броја алфа-честица, највећи њихов део има исти домет, а мањи део има више снопова различитог домета. То значи, да се алфа-честице, које емитује један исти извор, могу састојати из више група различитих брзина, односно енергија. Углавном се појављује спектар алфа-честица, састављен од две или више одвојених енергетских група.
Иако алфа-честице имају велику масу и енергију, ипак су њихови домети кратки, јер их хемијске материје кроз које пролазе заустављају. Ово заустављање настаје због медуделовања позитивно наелектрисаних алфа-честице и негативних електрона из материје кроз које пролазе. При томе, електрони могу бити избачени из атома те материје, а потребну енергију даје алфа-честица. Смањењем енергије алфа-честице смањује се и њена брзина, а то омогућава да се електрони с њима састављају, па се тако добијају атоми хелијума, који су електрично неутрални. Ипак, при томе кретању настаје врло јака јонизација.[7]
Јонизујуће зрачење уреди
Утврђено је да алфа-честице које зраче из разних радиоактивних елемената производе од 50 000 до 100 000 јонских парова, на један центиметар ваздуха, чиме настаје јонизујуће зрачење. Ако се направи дијаграм који ће на апсциси имати удаљеност алфа-честица од извора зрачења, а на ординати број јонизујућих парова које стварају алфа-честице на разним удаљеностима од извора, добија се Брагова крива. На њеном завршном делу, види се знатан успон, а затим нагли пад.
Тунел ефект уреди
Велика је потешкоћа настала да се објасни како је могуће да алфа-честице, чија кинетичка енергија износи при избацивању из радиоактивних атомских језгара од 4 до 10 MeV, да прођу кроз потенцијалну енергетску баријеру, чије највеће вредности код елемената с великим атомским бројем износе око 25 MeV. Према класичној теорији, излази да алфа-честице, које се налазе у унутрашњости атомског језгра, не могу да продру кроз баријеру и да се из њега се ослободе са енергијом која је мања од енергије потенцијалне баријере.
Исто тако, тешко је било објаснити зашто радиоактивни елементи имају тако дуго време полураспада, који на пример за радијум-226 износи 1600 година. То значи да се у тако дугом временском периоду, нуклеони (протони и неутрони) морају држати заједно у атомском језгру, иако понекад спонтано, без спољашњих утицаја, два протона и два неутрон у облику алфа-честице буду избачени из ње.
Тај проблем је теоретски решио 1928. Џорџ Гамов, а независно о њега Роналд Гурнеј и Едвард Кондон, развивши теорију тунелског ефекта. Према квантној физици постоји вероватноћа да се алфа-честица с одређеном енергијом, која је мања од енергије потенцијалне баријере, ослободи атомског језгра, кад дође до његове површине. Ова вероватноћа је већа ако је већа енергија алфа-честице и ако је ширина баријере мања од вредности њене енергије. Алфа-честица ће на неки начин добити довољну количину енергије од других нуклеарних честица, за свладавање потенцијалне баријере.
За алфа-честице способне да доспеју до вањске површине и да поновно буду убачене у атомско језгро, постоји учесталост. Вредност ове учесталости може се одредити дељењем величине полупречника атомског језгра с процењеном брзином, којом се алфа-честице крећу у атомском језгру. Будући да полупречник атомског језгра износи око 10-15 m, а брзина алфа-честице која се у њему креће износи око 106 m/s, излази да алфа-честица долази до вањске површине приближно 106/10-15 = 1021 пута у секунди, односно да она побегне из језгра након 1021 покушаја. То је у ствари бит тунел ефекта.
Акцелератори честица уреди
Акцелератор честица је уређај за убрзавање честице са електричним набојем до високих брзина. Убрзавање честица постиже се применом врло јаког електричног поља и/или магнетног поља. На пример, у електричном пољу енергија коју ће наелектрисана честица добити једнака је умношку њеног електричног набоја и разлике потенцијала почетне и крајње тачке пута. Сви акцелератори раде с високим вакуумом да омогуће несметано кретање честице. У акцелератору честица могу настати и алфа-честице.
Сунчево језгро уреди
Сунчево језгро се односи на унутрашњи део Сунца од центра до 20 – 25% Сунчевог полупречника. То је најтоплији део Сунчевог система. Његова густина се креће до 150 000 kg/m3 (150 пута више од густине воде) и температура је око 15 000 000 K (за разлику од површине где је око 6 000 К). Сунчево језгро се састоји од топлог и врућег гаса, који је у стању плазме. Унутар Сунчевог језгра се ствара 99% енергије нуклеарне фузије Сунца. У Сунчевом језгру могу настати и алфа-честице
Космички зраци уреди
Око 89% долазећих космичких зрака су једноставни протони (језгра водоника), 10% су језгра хелијума (алфа-честице) и 1% су тежи елементи. Та језгра водоника и хелијума чине 99% космичких зрака. Појединачни електрони (попут бета-честица) чине осталих 1% галактичких космичких зрака – то су козмички зраци које долазе изван Сунчевог система. Засад је непознато одакле ти електрони долазе и зашто имају убрзање мање од атомских језгара.
Историја уреди
Доња слика: Добијени резултати: само мали део алфа-честице скреће, показујући да постоји позитиван набој у атомском језгру (треба напоменути да мере нису стварне, атомско језгро је још пуно мање). То је Радерфордов модел атома.
Почетком 20. века било је познато 5 радиоактивних елемената: уранијум, торијум, полонијум, актинијум и радијум. Међу њима највише се употребљавао радијум и то за лечење рака. Из радијума и његових хемијских једињења стално се развијао један гас, који је исто био радиоактиван, а назван је радијумова еманација или радон. Осим радона настајао је и хелијум. Из тога се закључило да се радијум, али и сви остали радиоактивни елементи, претварају у друге елементе с мањом тежином и при том поступку зраче. Уочено је такође да је та природна радиоактивност својствена атомима с највећим атомским масама и да је то процес који се дешава у унутрашњости атома, те да не зависи од спољашњих утицаја, као што су притисак, температура или нека хемијска реакција.
Већ 1900. било је познато да један део радиоактивног зрачења може да скреће у магнетском пољу. Ернест Радерфорд је на основу испитивања пролаза радиоактивних зрака кроз танке листиће алуминијума утврдио да код зрачења уранијумових једињења постоје две врсте зрака. Ону врсту зрака који не могу да прођу кроз алуминијску плочицу дебљине 0,02 мм назвао је алфа-честицама, а ону врсту која је пролазила и кроз дебље слојеве назвао је бета-честицама. Исте године француски научник Пол Вилард је открио и трећу врсту радиоактивног зрачења, за коју се утврдило да има велику продорну моћ и да не скреће у магнетном пољу, а назване су гама-честицама. На основу скретања у магнетском пољу, утврђено је да алфа-честице имају позитивни електрични набој, а бета-честице негативан електрични набој.
Године 1908. су Радерфорд и Ханс Гајгер мерењем утврдили да алфа-честице имају двоструки електрични набој, а да им је маса једнака четворострукој маси атома водоника. Када алфа-честица привуче два електрона, она прелази у атом хелијума. Из тога је Радерфорд закључио да су алфа-честице у ствари јони хелијума или само атомска језгра хелијума. За бета-честице се утврдило да се у магнетном и електричном пољу понашају исто као и катодни зраци или електрони. То значи да су бета-честице у ствари електрони великих брзина, али за разлику од електрона у електронском омотачу атома, настају из атомског језгра.
Експеримент с алфа-честицама и златним листићем уреди
Експеримент с алфа-честицама и златним листићем је био један од најзначајнијих експеримената у нуклеарној физици, јер је то био први доказ да у атому постоји атомско језгро. Радерфорд је окупио плодан тим истраживача, међу којима су Ханс Гајгер, Ернест Марсден, Џорџ Хевеси, Хенри Мозли, а неколико је година део тима био и Нилс Бор.
Кључни се експеримент за то откриће догодио 1909. када су научници врло танку златну фолију изложили деловању алфа-честица. Томпсонов модел атома је предвиђао ће алфа-честице проћи кроз танки метални филм и распршити се под одређеним малим угловима. На велико је изненађење истраживачког тима установљено распршење и под великим угловима, а нека су се хелијумска језгра од металне фолије одбила потпуно уназад. Радерфорд је то упоредио с вероватноћом да лист папира одбија топовску куглу. Резултат експеримента је водио према новом моделу атома, који је Радерфорд предложио 1911. године: атом се састоји од средишњег набоја окруженог сферичном расподелом набоја супротног предзнака. У почетку се претпостављало да су и електрони градивне честице атомског језгра, па је у моделу за атом азота редног броја 7 било претпостављено да у језгру има 21 честицу, и то 14 протона и 7 електрона, а у електронском омотачу још 7 електрона.
Нуклеарна реакција уреди
Откриће спина и спектроскопија азотових језгара, до чега је 1930. дошао италијански физичар Франко Расети, је показало да се азотна језгра понашају као честице целобројног спина, тј. као бозони. То је било у потпуном нескладу с предложеним моделом азотног језгра са 21 нуклеоном, па је то неслагање названо „азотном катастрофом“. „Катастрофа“ је разрешена открићем неутрона, које је 1932. објавио Џејмс Чедвик и његовог спина 1/2. Руски је физичар Дмитри Иваненко предложио тада данашњи модел атома према којем су атомски нуклеони протони и неутрони, а не електрони. Назив протон за позитивно наелектрисани нуклеон први је употребио Радерфорд, а он је 1919. године извео и прво претварање (трансмутацију) једнога елемента у други; у тој је првој нуклеарној реакцији у историји бомбардовао азот алфа-честицама и тако добио кисеоник.
Радерфордово распршење уреди
Радерфордово распршење је појава из нуклеарне физике, којом се објашњава скретања алфа-честица које ударају у танке листиће метала, а с њим се доказује постојање позитивно наелектрисаног атомског језгра, која има готово сву масу атома. Радерфордово распршење је објашњење структуре атомског језгра, које је настало након експеримента са алфа-честицама и златним листићем. Резултати тог експеримента су показали да су скретања алфа-честица под великим угловима била јако ретка, на пример при пролазу кроз листић платине на сваких 8000 једна алфа-честица би скренула под иглом већим од 90º.
Прва нуклеарна претворба уреди
Године 1919. Ернест Радерфорд је, бомбардујући азот алфа-честицама извео прво нуклеарно претварање (трансмутацију) једног елемента у други. Радерфорд је приликом истраживања распршења алфа-честица кроз ваздух, открио да приликом бомбардовања атома азота са алфа-честицама настају нова језгра атома кисеоника и водоника.
- 14Н + α → 17О + протон
Антиалфа-честица уреди
Антиалфа-честица је досад најтеже откривено стабилно антијезгро. Чланови међународне истраживачке скупине СТАР су на Релативистичком сударачу тешких јона (енг. Relativistic Heavy Ion Collider - RHIC) открили антиматеријску копију алфа-честице 2011. Ова нова честица је најтеже антијезгро икад откривено. Релативистички сударач тешких јона је заправо акцелератор честица намењен проучавању услова у најранијем добу Свемира, а смјештен је у Националној лабораторији Брукхавен. Језгро антиалфа-честице се састоји од два антипротона и два антинеутрона, стабилно је и не улази у радиоактивни распад, наелектрисано је набојем два електрона док јој је маса готово четири пута већа од масе протона. Резултати истраживања показују како се новооткривене антиалфа-честице могу разлучити од лакших изотопа, али и да имају очекивану масу.
Стварање услова потребних за проучавање природе антиматерије није нимало лак задатак. Једна од највећих тајни физике је питање зашто се чини да је наш Свемир готово у потпуности изграђен од обичне материје када је научно прихваћена претпоставка да су у време Великог праска материја и антиматерија створене у исто време и у истим количинама.
За стварање услова сличних условима непосредно после Великог праска, у РХИЦ-у се сударају јони злата при брзинама блиским брзини светлости, при чему се ослобађају готово једнаке количине кваркова и антикваркова. Велик део стабилне материје настале током таквих судара оставља јасан сигнал на СТАР детектору пре него ли, заједно с обичном материјом, буде уништена у вањском делу уређаја.[8]
Примена уреди
Детектор дима уреди
Најчешћи детектори дима садрже мале количине радиоактивног изотопа америцијума-241, који се произведе нуклеарним реакцијама. Алфа-честица, која се емитује у распаду америцијума-241, јонизује ваздух и створа малу струју набоја који се мери осетљивим уређајем. Када дим уђе у детектор, јони се ухвате честицама дима што умањи струју набоја у детектору. Ако се то догоди, аларм се укључи. Како је преваљена удаљеност алфа-честица изузетно мала у ваздуху, не постоји ризик зрачења од оваквих детектора. Након своје упорабе, ови се детектори морају прикладно одлагати, као радиоактивни отпад.
Нуклеарне батерије уреди
Нуклеарне батерије су батерије у којим се одвија цепање језгра елемента уранијума-235 или плутонијума-239. У нуклеарној је батерији нуклеарна ланчана реакција цепања контролисана, тј. може се успорити или убрзати. Уређаји за претварање природног радиоактивног распадања директно у електричну енергију нису ништа ново. Технологија стварања нуклеарне батерије започела је још 1913., када је Хенри Мозли први пут демонстрирао тзв. Бета ћелију. Било је то у време када је све више расла потражња за дугорочним спремиштима енергије, посебно у сврхе свемирских истраживања 1950-тих и 1960-тих година. Током година, развили су се бројни типови и различити принципи рада нуклеарних батерија. Иако су већином ти принципи већ одавно познати, тек у новије време су се развиле технолошке могућности за израду саме батерије. Нуклеарне батерије које стварају алфа-честице је пуно лакше заштитити; довољно је само 2,5 мм оловног лима.
Елиминатори статичког електрицитета уреди
Неки елиминатори статичког електрицитета користе полонијум-210, који зрачи алфа-честице и јонизује ваздух, а тиме и поништава статички електрицитет.
Нуклеарна медицина: терапија уреди
Радиоактивни изотоп кобалт-60 емитује гама-зраке који се користе за разбијање ћелија рака, а слично томе и цезијум-137. У последњих десетак година терапија уништења ћелија рака врши се под директним снопом масивних јона из акцелератора. За разлику од гама-зрака, који деле своју енергију подједнако на здраво и нездраво ткиво, масивне честице попут протона и алфа-честица остављају своју енергију непосредно тамо где се зауставе. Ако се енергија прикладно одабере, највећи део енергије може се оставити у нездравом ткиву, а не у здравом ткиву.
Утицај алфа зрачења на живе организме уреди
Свет у коме живимо радиоактиван је од свог постанка. Постоји око 60 радионуклида (радиоактивних елемената), који се могу пронаћи у тлу, ваздуху, води, храни, а тиме и у свим живим бићима. По томе како су настали деле се на оне који су одувек присутни на Земљи, оне који настају као последица деловања космичких зрака, те оне који су последица људске технологије.
У првој су групи радиоактивни елементи попут уранијума-235, уранијума-238, торијума-232, радијума-226, радона-222 или калијума-40. Они потичу још из времена стварања Земље, а карактерише их врло дуго време полураспада, чак и до милијарду година (изузетак је гас радон, чији је полуживот 3,8 дана). Космичко зрачење нас непрестано погађа. Извор му је углавном изван нашег Сунчевог система, а састоји се од разних облика зрачења: од врло брзих тешких честица, па до високоенергијских фотона и миона. Оно међуделује с атомима у горњим слојевима атмосфере и тако производи радионуклиде, који су најчешће краћих времена полуживота. То су, на пример, угљеник-14, трицијум, берилијум-7 и други.
Људи су својим деловањем, превасходно развојем нуклеарних реактора и тестирањем нуклеарног оружја, створили још неке радиоактивне елементе, попут стронцијума-90, јода-129, јода-131, цезијума-137, плутонијума-239 итд.[9]
Мерне јединице јонизирајућег зрачења уреди
Активност радиоактивног узорка мери се у бекерелима (Bq). Активност од 1 Bq значи један распад атомског језгра у секунди. Како су активности узорака често врло велике у употреби је и већа јединица, кири (Ci). 1 Ci износи 3,7 • 1010 Bq.
Да би се мерила енергија, коју путем зрачења апсорбује одређена материје, користи се јединица греј (Gy). Однос те енергије и масе тела које је апсорбује зове се апсорбована доза. Ако се енергија од 1 J апсорбује у 1 kg материје говори се о апсорбованој дози од 1 Gy. Овако дефинисана доза не говори ништа о биолошким учинцима апсорбованог зрачења. Свака врста зрачења (α, β, γ) има другачији утицај на живе ћелије, који се описује фактором Q. Зато се дефинише еквивалентна доза, која се добија тако што се апсорбована доза помножи фактором Q. Јединица за еквивалентну дозу је сиверт (Sv).[10]
Референце уреди
- ^ „ЦОДАТА Валуе: Алпха партицле масс”. НИСТ. Приступљено 15. 9. 2011.
- ^ Кране, Кеннетх С. (1988). Интродуцторy Нуцлеар Пхyсицс. Јохн Wилеy & Сонс. стр. 246—269. ИСБН 978-0-471-80553-3.
- ^ Почела физике, Иван Супек, Мирослав Фурић, Школска књига, Загреб 1994
- ^ "Кемија I"[мртва веза], цхем.грф.унизг.хр, 2011.
- ^ "Од руде до жутог колача" Архивирано на сајту Wayback Machine (31. јул 2017), Нуклеарна електрана Кршко, 2011.
- ^ [1] Архивирано на сајту Wayback Machine (5. фебруар 2017) "4.1 ФИЗИКА НЕК-а - Фисија", Нуклеарна електрана Кршко, е-школа, 2011.
- ^ "Увод у нуклеарну енергетику"[мртва веза], Проф. др. сц. Данило Феретић, 2011.
- ^ "Откривена најтежа честица антиматерије", Знаност - Хрватски знанствени портал, 2011.
- ^ [2] Архивирано на сајту Wayback Machine (25. новембар 2012) "Јединица радиоактивности", www.радиобиологија.веф.унизг.хр, 2011.
- ^ "Јонизирајуће зрачење у биосфери" Архивирано на сајту Wayback Machine (5. јул 2010), Миле Џелалија, Кемијско-технолошки факултет, Свеучилиште у Сплиту, 2011.
Литература уреди
- Типлер, Паул; Ллеwеллyн, Ралпх (2002). Модерн Пхyсицс (4тх изд.). W. Х. Фрееман. ИСБН 978-0-7167-4345-3.