Амин (хемија)
| Примарни амин | Секундарни амин | Терцијарни амин |
|---|---|---|
 |
 |
 |
Амини припадају групи органских једињења која садрже најмање једну или више базних азотових атома у молекулу. Амини се сматрају дериватима амонијака и структурно су му сличи. Један или више водоникових атома замијењен са једном или више алкилних или арилних органских група.[1] Важни амини су аминокиселине, триметиламини, и анилини. Неоргански деривати амонијака се такође називају аминима, нпр. хлорамин (NClH2).
Слични аминима су амиди, међутим они су деривати карбоксилних киселина и имају карбонилну групу везану на амино скупину, нпр.: RC(O)NR2. Амиди и амини имају различиту структуру и својства, стога је разлика у називу важна. Супституент -NH2 се назива амино група.[2] Једињења са атомом азота везаним за карбонил групу, која имају структуру R–CO–NR′R″, се називају амидима и имају различита хемијска својства од амина.[3][4][5][6][7]
Номенклатура амина уреди
- префикс N означава супституцију на атому азота (нпр.: N,N-диметилетиламин)
- као префикс: „амино-”"
- као суфикс: „-амин”
Код нижих амина користи се суфикс -амин, а код виших амина користи се префикс амино-.
- Примарни амини: метиламин, етаноламин или 2-аминоетанол
- Секундарни амини: диметиламин, метилетаноламин или 2-(метиламино)етанол
- Терцијарни амини: триметиламин, диметилетаноламин или 2-(диметиламин)етанол
Четврта подкатегорија је одређена повезаношћу супституената везаних за азот:
- Циклични амини — Циклични амини су било секундарни или терцијарни амини. Примери цикличних амина су трочлани прстен азиридина и шесточлани прстен пиперидина. N-метилпиперидин и N-фенилпиперидин су примери цикличних терцијарних амина.
Исто тако је могуће да постоје четири органска супституента на азоту. Ове врсте нису амини већ су кватернарни амонијум катјони и имају наелектрисани азотни центар. Кватернарне амонијум соли постоје са многим врстама ањона.
Физичка својства уреди
Водонична веза знатно утиче на својства амина[8], због тога је тачка кључања виша него код сличних алкана и нижа од сличних алкохола. Због веће електронегативности кисеоника од азота, амини су више базични од алкохола и алкана који су тиме киселији. Амини мањих релативних молекулских маса (метил-, диметил-, триметил- и етиламин) су гасови при собној температури. Амини веће молекулске масе су течности или чврсте материје (диетиламин или триетиламин).
Гасовити амини имају неугодан мирис сличан амонијаку, док течни амини миришу попут покварене рибе. Амини с мањим бројем угљеникових атома добро се растварају у води стварајући водоничне везе, растворљивост се смањује с повећањем молекулске масе амина - односно хидрофобног дела молекула. Алифатични амини добро су растворни у органским растварачима, поготово поларним. Примарни амини реагирају са кетонима као што је ацетон.
Спектроскопска идентификација уреди
Типично се присуство аминске функционалне групе одређује комбинацијом техника, укључујући масену спектрометрију као и НМР и ИР спектроскопије. 1H НМР сигнали за амини нестају након третирања узорка са D2О. У свом инфрацрвеном спектру примарни амини испољавају две N-H везе, док секундарни амини имају само једну.[2]
Структура уреди
Алифатични амини уреди
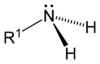
Разликују се три врсте амина: примарни, секундарни и терцијарни, и то с обзиром на број угљоводоничних група везаних за азотов атом умјесто водоника. Слово R означава органску (угљоводоничну) групу.
Алкил амини карактеристично имају тетраедралне азотне центре. C-N-C и C-N-H углови теже идеализованом углу 109°. C-N растојања су нешто краћа од C-C растојања. Енергетска баријера баријера за азотну инверзију стереоизомера је око 7 kcal/mol за триалкиламин. Интерконверзија се може упоредити са инверзијом отвореног кишобрана на јаком ветру.
Амини типа NHRR′ и NRR′R″ су хирални: азотни центар носи четири супституента рачунајући слободни пар. Услед ниске баријере инверзије, амини типа NHRR′ се не могу добити у оптички чистој форми. За хиралне терцијарне амине, NRR′R″ се једино може решити кад су R, R′, и R″ групе ограничене у цикличним структурама као што су N-супституисани азиридини (кватернарне амонијум соли се могу раздвојити).
| ⇌ | ||
| Инверзија амина. Пар тачака представља усамљени електронски пар на атому азота. | ||
Ароматични амини уреди
Ароматични амини на азотовом атому имају везан ароматични прстен, тривијално се зову анилини, пример је фениламин. Анилин и његови деривати су у индустријској синтези боја полазна једињења. Ароматични прстен снижава базичност амина зависно од супституената, а присуство амино групе повећава реактивност код ароматичног прстена, због електрон-донатора. Једна од реакција ароматичног прстена је Голдбергова реакција.[9][10]
У ароматичним аминима („анилинима”), азот је често скоро планаран услед конјугације слободног електронског пара са арил субституентом. C-N растојање је респективно краће. У анилину, C-N растојање је исто као C-C растојања.[11]
Базичност уреди
Попут амонијака, амини су базе.[12] У поређењу са алкалним металним хидроксидима, амини су слаби (погледајте табелу за примере Ка вредности конјугованих киселина).
| Алкиламин[13] ор анилине[14] | pKa протонованог амина | Kb |
|---|---|---|
| метиламин (MeNH2) | 10,62 | 4,17Е-04 |
| диметиламин (Me2NH) | 10,64 | 4,37Е-04 |
| триметиламин (Me3N) | 9,76 | 5,75Е-05 |
| етиламин (EtNH2) | 10,63 | 4,27Е-04 |
| анилин (PhNH2) | 4,62 | 4,17Е-10 |
| 4-метоксианилин (4-MeOC6H4NH2) | 5,36 | 2,29Е-09 |
| N,N-диметиланилин (PhNMe2) | 5,07 | 1,17Е-09 |
| 3-Нитроанилин (3-NO2-C6H4NH2) | 2,46 | 2,88Е-12 |
| 4-Нитроанилин (4-NO2-C6H4NH2) | 1 | 1,00Е-13 |
| 4-трифлуорометиланилин (CF3C6H4NH2) | 2,75 | 5,62Е-12 |
Базичност амина зависи од:
- Електронскиох својстава супституената (алкил групе повећавају базичност, арил групе смањују итд).
- Степена солвације протонисаног амина, чиме су обухваћени стерни ефекти група на азоту.
Електронски ефекти уреди
Захваљујући индуктивним ефектима, може се очекивати да се базичност амина повећава са бројем алкил група на амину. Корелације су компликоване због ефеката солватације који су супротни трендовима индуктивних ефеката. Ефекти солватације такође доминирају базичност ароматичних амина (анилина). За анилине, усамљени пар електрона на азоту се делокализује у прстен, што доводи до смањења базичности. Супституенти на ароматичном прстену, и њихови положаји у односу на амино групу, такође утичу на базичност као што се види у табели.
Солвациони ефекти уреди
Солватација значајно утиче на базичност амина. N-H групе формирају јаке интеракције са водом, а посебно амонијум јони. Насупрот томе, базичност амонијака се повећава за 1011 услед солвације. Интринзична базичност амина, тј. ситуација у којој је солватација неважна, је изучавана у гасној фази. У гасној фази амини показују базичности предвиђене из деловања органских супституената на ослобађање електрона. Тако су терцијарни амини у већој мери базични од секундарних амина, који су више базични од примарних амина, и на крају амонијак је најмање базичан. pKb редослед (базичности у води) не следи овај тренд. Слично томе анилин је више базичан од амонијака у гасној фази, али је десет хиљада пута мање базичан у воденом раствору.[15]
У апротичним поларним растварачима као што су DMSO, DMF, и ацетонитрил енергија солвације није једнако висока као у протичним растворима попут воде и метанола. Из тог разлога, базичност амина у тим апротичним растварачима је скоро потпуно вођена електронским ефектима.
Синтеза уреди
Алкилација уреди
Најзначајнији индустријски поступак припреме амина је путем алкилације амонијака алкохолима:[16]
- ROH + NH3 → RNH2 + H2O
За разлику од реакција амина са алкил халидима, овај индустријски метод је зелен у смилу да се као нуспроизвод формира вода. Реакција амина и амонијака са алкил халидима се користи за лабораторијску синтезу:
- RX + 2 R′NH2 → RR′NH + [RR′NH2]X
Такве реакције, које су најкорисније за алкил јодиде и бромиде, ретко се примењују јер је степен алкилације тешко контролисати.[16] Селективност се може побољшати путем Делепинове реакције, мада се она ретко користи у индустријским размерама.
Редуктивне руте уреди
Путем процеса хидрогенације, нитрили се редукују до амина користећи водоник у присуству никла као катализатора. Реакције су сензитивне за киселе и базне услове, што може да узрокује хидролизу –CN групе. LiAlH4 се чешће користи за редукцију нитрила у лабораторијским размерама. Слично томе, LiAlH4 редукује амиде до амина. Многи амини се формирају из алдехида и кетона путем редуктивне аминације, која се може одвијати било каталитички или стехиометријски.
Анилин (C6H5NH2) и његов и деривати се припремају редукцијом нитроароматичних једињења. У индустрији, водоник је преферентни реактант, док се у лабораторијским условима често користе калај и гвожђе.
Неке врсте амина уреди
Алкалоиди уреди
Алкалоиди су амини у природи, посебно у биљном свету. У природи већином настају из аминокиселина. Знатан број алкалоида је отрован, горког укуса с врло јаким фармаколошким учинком. Примери алкалоида: кофеин (налази се у кафи, чају, безалкохолним пићима, летална доза кофеина је 10 грама), никотин (налази се у лишћу духана, летална доза никотина је 500 милиграма (у крвотоку)), морфин (налази се у опијуму, осушеном соку из мака).
Триптамини уреди
Триптамини су алкалоидни моноамини. Стварају се око индолног прстена. Одговарају аминокиселини триптофан. Неки делују као неуротрансмитери, а неки као халуциногени (психоактивне дроге, психоделичне дроге). Примери триптамина: серотонин, мелатонин, диметилтриптамин, псилоцин. Дроге врсте триптамина се налазе у породици (ТиХКАЛ).
Фенилетиламини уреди
Фенилетиламини су алкалоидни моноамини. Одговарају аминокиселини фенилаланин. Супституисани фенилетиламини су једињења са мноштвом функција: неуротрансмитери, хормони, стимуланти, халуциногени, антидепресиви. Примери фенилетиламина: допамин, адреналин, норадреналин, амфетамин, метамфетамин, мескалин, МДМА, тирамин, салбутамол. Друге врсте фенилетиламина се налазе у породици (PiHKAL).
Види још уреди
Референце уреди
- ^ МцМуррy Јохн Е. (1992). Фундаменталс оф Органиц Цхемистрy (3рд изд.). Белмонт: Wадсwортх. ISBN 0-534-16218-5.
- ^ а б Smith, Janice Gorzynski (2011). „Chapter 25 Amines”. Ур.: Hodge, Tami; Nemmers, Donna; Klein, Jayne. Organic chemistry (на језику: енглески) (3rd изд.). New York, NY: McGraw-Hill. стр. 949—993. ISBN 978-0-07-337562-5. Архивирано из оригинала (Book) 28. 06. 2018. г. Приступљено 12. 05. 2019.
- ^ Harrison L. G. : The shaping of life: The generation of biological pattern. . Cambridge University Press. 2011. ISBN 978-0-521-55350-6.; http://books.google.com/books?id=-IPG-vg7Pr8C.
- ^ Хаџиселимовић Р., Појскић Н. : Увод у хуману имуногенетику. Институт за генетичко инжењерство и биотехнологију (ИНГЕБ), Сарајево. 2005. ISBN 978-9958-9344-3-8.
- ^ Alberts B. ː Molecular biology of the cell. Garland Science. . New York. 2002. ISBN 978-0-8153-3218-3.
- ^ Бајровић К, Јеврић-Чаушевић А., Хаџиселимовић Р., Ед. : Увод у генетичко инжењерство и биотехнологију. Институт за генетичко инжењерство и биотехнологију (ИНГЕБ), Сарајево. 2005. ISBN 978-9958-9344-1-4.
- ^ Капур Појскић L., Ед. : Увод у генетичко инжењерство и биотехнологију, 2. издање. Институт за генетичко инжењерство и биотехнологију (ИНГЕБ), Сарајево. 2014. ISBN 978-9958-9344-8-3.
- ^ Лиде Давид Р., ур. (2006). ЦРЦ Хандбоок оф Цхемистрy анд Пхyсицс (87тх изд.). Боца Ратон, ФЛ: ЦРЦ Пресс. ISBN 978-0-8493-0487-3.
- ^ Ullmann, Fritz (1905). „Ueber die Phenylirung von Phenolen”. Berichte der deutschen chemischen Gesellschaft. 38 (2): 2211—2212. doi:10.1002/cber.190503802176.
- ^ Irma Goldberg (1906). „Ueber Phenylirungen bei Gegenwart von Kupfer als Katalysator”. Berichte der deutschen chemischen Gesellschaft. 39 (2): 1691—1692. doi:10.1002/cber.19060390298.
- ^ G. M. Wójcik "Structural Chemistry of Anilines" in Anilines (Patai's Chemistry of Functional Groups), S. Patai, Ed. 2007, Wiley-VCH, Weinheim. . doi:10.1002/9780470682531.pat0385. Недостаје или је празан параметар
|title=(помоћ) - ^ Smith, J. W. (1968). S. Patai, ур. „Basicity and complex formation”. Patai's Chemistry of Functional Groups. doi:10.1002/9780470771082.ch4.
- ^ Hall, H. K. (1957). „Correlation of the Base Strengths of Amines”. Journal of the American Chemical Society. 79 (20): 5441—5444. doi:10.1021/ja01577a030.
- ^ Kaljurand, I.; Kütt, A.; Sooväli, L.; Rodima, T.; Mäemets, V.; Leito, I.; Koppel, I. A. (2005). „Extension of the Self-Consistent Spectrophotometric Basicity Scale in Acetonitrile to a Full Span of 28 pKa Units: Unification of Different Basicity Scales”. The Journal of Organic Chemistry. 70 (3): 1019—1028. PMID 15675863. doi:10.1021/jo048252w.
- ^ Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th изд.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
- ^ а б Eller, Karsten; Henkes, Erhard; Rossbacher, Roland; Höke, Hartmut (2000). „Amines, Aliphatic”. Ullmann's Encyclopedia of Industrial Chemistry. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a02_001.