Флуороантимонска киселина
Флуороантимонска киселина (HSbF6) представља мешавину флуороводоника и антимон-пентафлуорида у различитим односима. Комбинација 1:1 формира најјачу познату суперкиселину, која може да протонизује и угљоводонике при чему се добију карбокатјони и H2.

| |
| Називи | |
|---|---|
| Преферисани IUPAC назив
Флуороантимониц ацид | |
| Системски IUPAC назив
Хyдроген хеxафлуоро-λ5-стибануиде | |
| Други називи
H(+) хексафлуоро-λ5-стибануид
| |
| Идентификација | |
3Д модел (Jmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.037.279 |
| EC број | 241-023-8 |
| |
| Својства | |
| HSbF6 | |
| Моларна маса | 236,808 g/mol |
| Агрегатно стање | безбојни сируп |
| Густина | g cm–3 |
| Тачка топљења | °C na mmHg |
| Тачка кључања | razlaže se |
| разлаже се | |
| Киселост (пКа) | −25 |
| Опасности | |
| Опасност у току рада | корозивна |
| Р-ознаке | R26, R29, R35 |
| Тачка паљења | незапаљива |
| Сродна једињења | |
Други ањони
|
HBF4 |
Други катјони
|
NaPF6, NaSbF6 |
Сродне киселине
|
HF SbF5 Магична киселина |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25 °C [77 °F], 100 kPa). | |
| Референце инфокутије | |
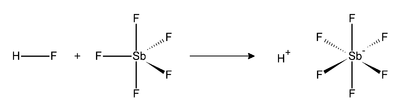
Реакција између водоникфлуорида (HF) и SbF5 је егзотермна. HF ослобађа свој протон (H+) и његова коњугована база (F−) је узета од стране SbF5 при чему се добије октаедарни SbF6−. Овај ањон је класификован као некоординирајући, зато што је веома слаб нуклеофил и веома слаба база. Протон ефективно постаје "го" што доприноси великој киселости. Флуорантимонска киселина је 2×1019 пута јача од 100% сумпорне киселине.
Структура уреди
Из мјешавине HF-SbF5 су кристализована два продукта, и оба су била анализирана уз помоћ рендгенске анализе кристала. Ове соли имају формуле [H2F+][Sb2F11−] и [H3F2+][Sb2F11−]. У обе соли постоји ањон Sb2F11−. Као што је већ речено SbF6− спада у слабе базе, а већи ањон Sb2F11− је још слабија база.
Примјена уреди
Ова јака киселина протонизује скоро сва органска једињења. Показано је 1967. године да ће HF-SbF5 уклонити H2 из изобутана и метан из неопентана:
- (CH3)3CH + H+ → (CH3)3C+ + H2
- (CH3)4C + H+ → (CH3)3C+ + CH4
Мјере опреза уреди
HF-SbF5 се разлаже са водом брзо и експлозивно. Реагује са скоро свим растварачима. Растварач који је компатибилан са HF-SbF5 је SO2ClF и течни сумпор диоксид. Фреони су такође користе као растварачи. Посуде за HF-SbF5 се праве од политетрафлуоретилена.
Референце уреди
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.