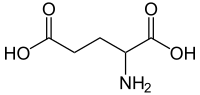
Глутаминска киселина
Глутаминска киселина (Glu или E) је једна од 20 протеинских аминокиселина.[3] Њени кодони су GAA и GAG. То је не-есенцијална аминокиселина. Карбоксилатни ањони и соли глутаминске киселине су познати као глутамати.
| |

| |
| Називи | |
|---|---|
| IUPAC назив
Glutaminska kiselina
| |
| Други називи
2-Аминопентандиоксична киселина
| |
| Идентификација | |
3Д модел (Jmol)
|
|
| Абревијација | Glu, E |
| ChemSpider | |
| ECHA InfoCard | 100.009.567 |
| Е-бројеви | Е620 (појачивач укуса) |
| МеСХ | Глутамиц+ацид |
| |
| Својства | |
| C5H9NO4 | |
| Моларна маса | 147,13 g·mol−1 |
| Агрегатно стање | бео кристални прах |
| Густина | 1,4601 (20°C) |
| Тачка топљења | 199°C dekomp. |
| растворан | |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25 °C [77 °F], 100 kPa). | |
| Референце инфокутије | |
Хемија уреди
Бочни ланац, карбоксилно киселинска функционална група, има pKa од 4.1, и она је у негативно наелектрисаном депротонисаном карбоксилатном облику на физиолошком pH.[3]
Историја уреди
Мада су глутаминска киселина и друге аминокиселине природно присутне у многим врстама хране, њихови доприноси укусу су научно идентификовани тек у раном двадесетом веку. Супстанцу је открио и идентификовао 1866. године Немачки хемичар Karl Heinrich Leopold Ritthausen. 1907. године Јапански истраживач Kikunae Ikeda са Токијског Империјалног Универзитета је идентификовао смеђе кристале заостале након евапорације веће количине комбу супе као глутаминску киселину. Ти кристали, су имали укус, који је подсећао непотпуно израженом али неоспорном укусу присутном у многим другим врстама хране, и поготову у морској трави. Професор Икеда је назвао тај укус меса, и друге високопротеинске хране, умами. Он је након тога патентирао метод за масовну-производњу кристалне соли глутаминске киселине, моно-натријум глутамата.[4][5]
Биосинтеза уреди
| Реактанти | Производи | Ензими |
|---|---|---|
| Глутамин + H2O | → Glu + NH3 | GLS, GLS2 |
| NAcGlu + H2O | → Glu + Ацетат | (непознато) |
| α-кетоглутарате + NADPH + NH4+ | → Glu + NADP+ + H2O | ГЛУД1, ГЛУД2 |
| α-кетоглутарат + α-амино киселина | → Glu + α-оксо киселина | трансаминаза |
| 1-пиролин-5-карбоксилат + NAD+ + H2O | → Glu + NADH | ALDH4A1 |
| N-формимино-L-глутамат + FH4 | → Glu + 5-формимино-FH4 | FTCD |
Функција и употреба уреди
Метаболизам уреди
Глутамат кључни молекул у ћелијском метаболизму. Код људи, дијетарни протеини се разлажу у аминокиселине, које служе као метаболичко гориво за друге функционалне процесе у телу. Кључни процес у деградацији аминокиселина је трансаминација, у коме се амино група једне амино киселине преноси на α-кетокиселину, што је типично катализовано трансаминазама. Та реакција се може генералисати као:
- R1-амино киселина + R2-α-кетокиселина ⇌ R1-α-кетокиселина + R2-аминокиселина
Веома распрострањена α-кетокиселина је α-кетоглутарат, која је интермедијар циклуса лимунске киселине. Трансаминација оф α-кетоглутарата производи глутамат. Резултујући α-кетокиселински продукт је такође користан, јер може бити коришћен било као гориво или супстрат за даље метаболичке процесе. На пример:
- Аспартат + α-кетоглутарат ⇌ оксалоацетат + глутамат
Пируват и оксалоацетат су кључне компоненте целуларног метаболизма, које контрибуирају као супстрати или интермедијери у фундаменталним процесима као што су гликолиза, глуконеогенеза и исто тако Кребсов циклус.
Глутамат игра важну улогу у одстрањивању из тела сувишног или бескорисног азота. Глутамат подлеже деаминацији, једној оксидативној реакцији коју каталише глутамат дехидрогеназа, на следећи начин:
Амонијак (као амонијум) се онда излучује првенствено као уреја, синтетизована у јетри. Трансаминација може тако бити повезана са деаминацијом, ефективно дозвољавајући азоту из амин група амино киселина да буду одстрањен, путем глутамата као интермедијара, и коначно излучен из тела у облику уреје.
Неуротрансмитер уреди
Глутамат је најраспрострањенији узбуђујући неуротрансмитер у кичмењачком нервном систему. У хемијским синапсама, глутамат се налази у мехурићима. Нервни импулси изазивају ослобађање глутамата ис пре-синаптичких ћелија. У наспрамним пост-синаптичким ћелијама, глутаматни рецептори, као што је НМДА рецептор, везују глутамат и активирају се. Због његове улоге у синаптичкој пластичности, глутамат је везан за когнитивне функције као што су учење и меморија у мозгу[6]. Форма пластичности позната као дуготрајна потенцијација се дешава на глутаматергичким синапсама у хипокампусу, неокортексу, и другим деловима мозга. Глутамат не функционише само као тачка до тачке трансмитер него и путем преливног синаптичког преслушавања између синапси у коме сумација глутамата ослобођеног из суседних синапси ствара екстрасиптичку сигнализацију/просторну трансмисију.[7]
Глутаматни транспортери[8] се налазе у неуронима и глиалним мембранама. Они брзо одстрањују глутамат из екстрацелуларног простора. Код можданих повреда или болести, они могу да раде у реверзно, и вишак глутамата се може акумулирати изван ћелија. Тај процес узрокује да калцијум јони продиру у ћелију путем канала НМДА рецептора, што доводи до неуронког оштећења и евентуално до ћелијске смрти, то се зове ексцитотоксичност. Механизам апоптозе уврштава:
- Оштећење митохондрије због сувише високе интрацелуларне Ca2+ концентрације.[9]
- Glu/Ca2+-посредована промоција транскрипционих фактора за проапоптотичке гене, или потискивање транскрипционих фактора за антиапоптотичке гене.
Ексцитотоксичност узрокована глутаматом се јавља као део исцхемичне каскаде, и асоцирана је са можданим ударом, и болестима као што су амиотрофична латерална склероза, латиризам, аутизам, неки облици менталне ретардације, и Алцхајмерова болест[10].
Глутаминска киселина је била повезана са епилептичким нападима. Микроињекција глутаминске киселине у неуроне производи низ спонтаних деполаризација са размаком од једне секунде, и тај патерн паљења је сличан оном који је познат као пароксизмално деполаризујуће померање код епилептичког напада. Та промена потенцијала неактивиране мембране у жижи епилептичког напада може да проузрокује спонтано отварање напонски-активираног калцијум канала, што доводи до ослобађања глутаминске киселине и даље деполаризације.
Експерименталне технике за детекцију глутамата у неоштећеним ћелијама уврштавају генетички-дизајниран наносензор.[11] Сенсор је фузија глутамат-везујућег протеина и два флуоресцентна протеина. Кад се глутамат веже, флуоресценција сензора под ултравиолентним светлом се промени путем резонанце између два флуорофора. Увођење наносензора у ћелије омогућава оптичку детекцију концентрације глутамата. Синтетички аналози глутаминске киселине који се могу активирати ултравиолентним светлом и дво-фотонска ексцитациона микроскопија су исто биле описане.[12] Метод брзог ослобађања путем фотостимулације је користан за мапирање конекција између неурона, и разумевање функција синапсе.
Еволуција глутамат рецептора је потпуно различита код безкичмењака, посебно артропода и нематода, где глутамат стимулише глутамат-контролисане хлорид канале. Бета подјединице рецептора су респонсивне са веома високим афинитетом на глутамат и глицин.[13] Модулација тих рецептора је била терапеутски циљ антипаразитне терапије користећи авермектине. Авермектинова мета је алфа-подјединица глутамат-контролисаног хлоридног канала.[14] Ти рецептори су били описани код артропода, као што је Drosophila melanogaster[15] и Lepeophtheirus salmonis.[16] Неповратна активација тих рецептора са авермектином резултује у хиперполаризацији у синапсама и неуромускуларним саставима, резултујући у флацидној парализи, и угинућу нематода и артропода.
Мождана нон-синаптичка глутаматергична сигнализациона кола уреди
Екстрацелуларни глутамат у мозгу Дрозофиле је био нађен да регулише груписање пост-синаптичког глутамат рецептора, кроз процес који уврстава десензитизацију рецептора.[17] Гени изражени у глијалним ћелијама активно транспортују глутамат у екстрацелуларни простор,[17] док код nucleus accumbens услед стимулисања групе II метаботрописког глутамат рецептора, ти гени су нађени да смањују нивое екстрацелуларног глутамата.[18] То отвара могућност да тај екстрацелуларни глутамат игра улогу сличну ендокрину као део већег хомеостатичног система.
ГАБА прекурзор уреди
Глутамат исто служи као прекурзор за синтезу инхибиторног ГАБА лиганда у ГАБА-ергичним неуронима. Та реакција је каталисана глутамат декарбоксилазом (ГАД), која је најзаступљенија у церебелуму и у панкреасу.
Синдром круте-особе је неуролошки поремећај изазван антиГАД антителима, што доводи до умањења ГАБА синтезе и отуда, умањених моторних функција као што су мускуларна крутост и спазам. Пошто је панкреас исто богат овим ензимом (ГАД), директна имунолошка деструкција се јавља у панкреасу и пацијенти оболевају од дијабетиса.
Појачивач укуса уреди
Слободна глутаминска киселине је присутна у широком асортиману хране, укључујући сир и соја сос, и оне је одговорна за један од пет основних укуса људског чула укуса (умами). Глутаминска киселина се често користи као прехрамбени адитив и појачивач укуса у облику њене натријумове соли, моно-натријум глутамата (МСГ).
Хранљиви састојак уреди
Сва меса, живина, риба, јаја, млечни производи, као и kombu су изврсни извори глутаминске киселине. Нека протеин-богата биљна храна исто служи као извор. Деведесет пет процената млечног глутамата је метаболизовано у интестиналним ћелијама у првом пролазу.[19]
Узгој биљака уреди
Auxigro је препарација биљног хормона раста која садржи 30% глутаминске киселине.
Производња уреди
Кинеска Fufeng Grupa Limited је највећи произвођач глутаминске киселине на свету, са капацитетом повећаним до преко 300,000 тона на крају 2006 од 180,000 тона у току 2006, чиме они покривају 25%-30% Кинеског тржишта. Meihua други по величини Кинески произвођач.
Фармакологија уреди
Лек фенциклидин (боље познат као ПЦП) нон-компетитивно антагонизира глутаминску киселину на НМДА рецептору. Из истог разлога, суб-анастетичке дозе кетамина имају јаке дисоцијативне и халуциногене ефекте. Глутамат не пролази лако кроз крвно мождану баријеру, али је уместо тога његов транспорт посредован транспортним системом високог афинитета.[20] Он се може конвертовати у глутамин.
Види још уреди
Референце уреди
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б David L. Nelson; Michael M. Cox (2005). Principles of Biochemistry (IV изд.). New York: W. H. Freeman. ISBN 0-7167-4339-6.
- ^ Renton, Alex (10. 7. 2005). „If MSG is so bad for you, why doesn't everyone in Asia have a headache?”. The Guardian. Приступљено 21. 11. 2008.
- ^ „Kikunae Ikeda Sodium Glutamate”. Japan Patent Office. 7. 10. 2002. Архивирано из оригинала 28. 10. 2007. г. Приступљено 21. 11. 2008.
- ^ McEntee, W. & Crook, T (1993). „Glutamate: its role in learning, memory, and the aging brain.”. Psychopharmacology. 111 (4): 391—401. PMID 7870979.
- ^ Okubo Y, Sekiya H, Namiki S, Sakamoto H, Iinuma S, Yamasaki M, Watanabe M, Hirose K, Iino M. (2010). Imaging extrasynaptic glutamate dynamics in the brain. Proc Natl Acad Sci U S A. . 107: 6526—6531. PMID 20308566. doi:10.1073/pnas.0913154107. Недостаје или је празан параметар
|title=(помоћ) - ^ Shigeri Y, Seal RP, Shimamoto K (2004). „Molecular pharmacology of glutamate transporters, EAATs and VGLUTs”. Brain Res. Brain Res. Rev. 45 (3): 250—65. PMID 15210307. doi:10.1016/j.brainresrev.2004.04.004.
- ^ Manev H, Favaron M, Guidotti A, Costa E (1989). „Delayed increase of Ca2+ инфлуx елицитед бy глутамате: роле ин неуронал деатх”. Мол. Пхармацол. 36 (1): 106—12. ПМИД 2568579.
- ^ Хyнд МР, Сцотт ХЛ, Додд ПР (2004). „Глутамате-медиатед еxцитотоxицитy анд неуродегенератион ин Алзхеимер'с дисеасе.”. Неуроцхем Инт. 45 (5): 583—95. ПМИД 15234100.
- ^ Окумото, С.; et al. (2005). „Detection of glutamate release from neurons by genetically encoded surface-displayed FRET nanosensors”. Proceedings of the National Academy of Sciences U.S.A. 102 (24): 8740—8745. PMC 15939876 . PMID 15939876. doi:10.1073/pnas.0503274102.
- ^ Ellis-Davies, G.C.R.; et al. (2007). „4- Carboxymethoxy-5,7-dinitroindolinyl-Glu: an improved caged glutamate for expeditious ultra- violet and 2-photon photolysis in brain slices”. Journal of Neuroscience. 27 (Jun): 6601—6604. PMID 17581946. doi:10.1523/JNEUROSCI.1519-07.2007.
- ^ Laughton, D.L., Wheeler, S.V., Lunt, G.G. and Wolstenholme, A.J. 1995. "The beta-subunit of Caenorhabditis elegans avermectin receptor responds to glycine and is encoded by chromosome 1". J. Neurochem. 64, 2354-2357
- ^ Cully, D.F., Vassilatis, D.K., Liu, K.K., Paress, P.S., Van der Ploeg, L.H.T., Schaeffer, J.M. and Arena, J.P. 1994. "Cloning of an avermectin-sensitive glutamate gated choride channels from Caenorhabditis elegans". Nature 371, 707-711
- ^ Cully, D.F., Paress, P.S., Liu, K.K., Schaeffer, J.M. and Arena, J.P. 1996. "Identification of a Drosophila melanogaster glutamate-gated chloride channel sensitive to the antiparasitic agent avermectin". J. Biol. Chem. '271, 20187-20191'
- ^ Tribble, N.D., Burka, J.F. and Kibenge, F.S.B. 2007. "Identification of the genes encoding for putative gamma aminobutyric acid (GABA) and glutamate-gated chloride channel (GluCl) alpha receptor subunits in sea lice (Lepeophtheirus salmonis)". J. Vet. Pharmacol. Ther. 30, 163-167
- ^ а б Augustin H, Grosjean Y, Chen K, Sheng Q, Featherstone DE (2007). „Nonvesicular release of glutamate by glial xCT transporters suppresses glutamate receptor clustering in vivo”. Journal of Neuroscience. 27 (1): 111—123. PMC 2193629 . PMID 17202478. doi:10.1523/JNEUROSCI.4770-06.2007.
- ^ Xi, Zheng; Baker, DA; Shen H; Carson, DS; Kalivas, PW (2002). „Group II metabotropic glutamate receptors modulate extracellular glutamate in the nucleus accumbens”. Journal of Pharmacology and Experimental Therapeutics. 300 (1): 162—171. PMID 11752112. doi:10.1124/jpet.300.1.162.
- ^ Reeds, P.J.; et al. (1. 4. 2000). „Интестинал глутамате метаболисм”. Јоурнал оф Нутритион. 130 (4с): 978С—982С. ПМИД 10736365.
- ^ Смитх, QР (2000). „Транспорт оф глутамате анд отхер амино ацидс ат тхе блоод-браин барриер”. Ј. Нутр. 130 (4С Суппл): 1016С—22С. ПМИД 10736373.