Keton
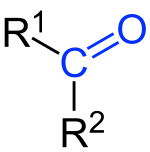
Ketoni su organska jedinjenja sa kiseonikom koja sadrže karbolnilnu, keto-grupu.[1] Za ugljenikov atom karbonilne grupe vezane su dve akil-grupe. Ketoni nastaju oksidacijom sekudarnih alkohola. Opšta ketona formula je: R1(CO)R2.[2] Najjednostavniji keton je aceton (R = R' = metil), sa formulom CH3C(O)CH3. Mnogi ketoni su od velike važnosti u industriji i biologiji. Primeri uključuju mnoge šećere (ketoze), mnoge steroide (npr. testosteron) i rastvarač aceton.[3]
Nomenklatura i etimologija uredi
Reč keton je izvedena iz Aketon, stare nemačke reči za aceton.[4][5][6]
Po IUPAC nomenklaturi, ketoni se imenjuju promenom sufiksa -an na početnom alkanu u -anon. Položaj karbonilne grupe obično se označava brojem. Za važnije ketone se koriste tradicionalna nesistematska imena, na primer aceton i benzofenon. Ta nesistematska imena se smatraju zadržanim IUPAC imenima,[7] mada pojedini udžbenici koriste imena poput 2-propanon ili propan-2-on umesto acetona, najjednostavnijeg ketona (-C H3-CO-CH3}-). Pozicija karbonilne grupe se obično označava brojem.
Izvedena imena ketona dobijaju se odvojenim pisanjem imena dve alkilne grupe povezane sa karbonilnom grupom, a zatim kao posebna reč sledi „keton“. Imena alkilnih grupa se pišu po redosledu sve veće složenosti: na primer, metil etil keton. Prema pravilima IUPAC nomenklature, alkilne grupe se pišu po abecedi, tj. etil metil keton. Kada su dve alkilne grupe iste, prefiks „di-“ se dodaje ispred imena alkilne grupe. Položaji ostalih grupa označeni su grčkim slovima, α-ugljenik je atom uz karbonilnu grupu.
Iako se retko koristi, okso je deo IUPAC nomenklatura za okso grupu (=O) i koristi se kao prefiks kada keton nema najveći prioritet. Međutim, koriste se i drugi prefiksi. Za neke uobičajene hemikalije (uglavnom u biohemiji), keto se odnosi na ketonsku funkcionalnu grupu.
Struktura i svojstva uredi
Ketonski ugljenik se često opisuje kao „sp2 hibridizovan“, što je opis koji uključuje i njihovu elektronsku i molekularnu strukturu. Ketoni su trigonalno planarni oko ketonskog ugljenika, sa uglovima veze C−C−O i C−C−C od približno 120°. Ketoni se razlikuju od aldehida po tome što je karbonilna grupa (CO) vezana za dva ugljenika unutar ugljeničnog skeleta. U aldehidima, karbonil je vezan za jedan ugljenik i jedan vodonik, i nalazi se na krajevima ugljeničnih lanaca. Ketoni se takođe razlikuju od ostalih funkcionalnih grupa koje sadrže karbonil, poput karboksilnih kiselina, estara i amida.[8]
Karbonilna grupa je polarna, jer je elektronegativnost kiseonika veća od one za ugljenik. Dakle, ketoni su nukleofilni na kiseonik i elektrofilni na ugljeniku. Budući da karbonilna grupa formira interakcije sa vodom putem vodoničnog vezivanja, ketoni su tipično rastvorljiviji u vodi od srodnih metilenskih jedinjenja. Ketoni su akceptori vodonične veze. Ketoni obično nisu donatori vodonične veze i ne mogu se vodoničnom vezom vezati za sebe. Zbog nemogućnosti da služe kao donatori i akceptori vodoničnih veza, ketoni nemaju tendenciju „samopovezivanja“ i isparljiviji su od alkohola i karboksilnih kiselina slične molekulske težine. Ovi faktori doprinose sveprisutnosti ketona u parfimeriji i kao rastvarača.
Klase ketona uredi
Ketoni se klasifikuju na osnovu njihovih supstituenata. Jedna široka klasifikacija deli ketone na simetrične i nesimetrične derivate, u zavisnosti od ekvivalencije dva organska supstituenta vezana za karbonilni centar. Aceton i benzofenon (C6H5C(O)C6H5) su simetrični ketoni. Acetofenon (C6H5C(O)CH3) je asimetrični keton.
Diketoni uredi
Poznate su mnoge vrste diketona, neke od kojih imaju neobična svojstva. Najjednostavniji je diacetil (CH3C(O)C(O)CH3), nekada korišten kao aroma putera u kokicama. Acetilaceton (pentan-2,4-dion) je praktično pogrešan naziv (neodgovarajući naziv), jer ova materija postoji uglavnom kao monoenol CH3C(O)CH=C(OH)CH3. Njegov enolat je uobičajeni ligand u koordinacionoj hemiji.
Nezasićeni ketoni uredi
Ketoni koji sadrže alkenske i alkinske jedinice često se nazivaju nezasićeni ketoni. Najčešći član ove klase jedinjenja je metil vinil keton, CH3C(O)CH=CH2, koji je koristan u Robinsonovoj anulacionoj reakciji. Da ne bi došlo do zabune, sam keton je mesto nezasićenja; odnosno može se hidrogenizovati.
Ciklični ketoni uredi
Mnogi ketoni su ciklični. Najjednostavnija klasa ima formulu (CH2)nCO, gde n varira od 2 za ciklopropanon do viših analoga. Postoji mnoštvo većih derivata. Cikloheksanon, simetrični ciklični keton, važan je međuprodukt u proizvodnji najlona. Izoforon, izveden iz acetona, je nezasićeni, asimetrični keton koji je prekurzor drugim polimerima. Muskon, 3-metilpentadekanone, je životinjski feromon. Još jedan ciklični keton je ciklobutanon, koji ima formulu C4H6O.
Keto-enolni tautomerizam uredi
Ketoni koji imaju najmanje jedan alfa-vodonik, podvrgavaju se keto-enolnoj tautomerizaciji; tautomer je enol. Tautomerizaciju katalizuju kiseline i baze. Obično je keto oblik stabilniji od enola. Ova ravnoteža omogućava pripremu ketona hidracijom alkina.
Kiselo/bazna svojstva ketona uredi
C-H veze susedne karbonilu u ketonima su kiselije (pKa ≈ 20) od veza C-H u alkanu (pKa ≈ 50). Ova razlika odražava rezonantnu stabilizaciju enolatnog jona koji nastaje deprotonovanjem. Relativna kiselost α-vodonika je važna u reakcijama enolizacije ketona i drugih karbonilnih jedinjenja. Kiselost α-vodonika takođe omogućava ketonima i drugim karbonilnim jedinjenjima da reaguju kao nukleofili na tom položaju, sa bilo stehiometrijskom ili katalitičkom bazom. Koristeći vrlo jake baze poput litijum-diizopropilamida (LDA, pKa konjugovane kiseline ~36) u neuravnoteženim uslovima (–788 °C, 1,1 ekvivalenta LDA u THF, keton dodat u bazu), manje supstituisani kinetički enolat se generiše selektivno, dok uslovi koji omogućavaju ravnotežu (viša temperatura, baza dodata ketonu, upotrebom slabih ili nerastvorljivih baza, npr. NaOEt u EtOH, ili NaH) daju supstituisaniji termodinamički enolat.
Ketoni su takođe slaba baza, koja podleže protonaciji na karbonilnom kiseoniku u prisustvu Brenstedovih kiselina. Ketonijumovi joni (tj. protonovani ketoni) jake su kiseline, čija se pKa vrednost procenjuje na između –5 i –7.[9][10] Iako su kiseline koje se sreću u organskoj hemiji retko dovoljno jake da u potpunosti protoniraju ketone, formiranje ravnotežnih koncentracija protonovanih ketona je ipak važan korak u mehanizmima mnogih uobičajenih organskih reakcija, poput stvaranja acetala, na primer. Veoma slabe kiseline, kao što je piridinijum katijon (kakav se nalazi u piridinijum tosilatu) sa pKa 5,2 mogu da posluže kao katalizatori u ovom kontekstu, uprkos vrlo nepovoljnoj konstanti ravnoteže za protonaciju (Keq < 10−10).
Karakteristike uredi
Aldehid se razlikuje od ketona po tome što ima atom vodonika vezan za svoju karbonilnu grupu, čineći aldehide lakšim za oksidaciju. Ketoni nemaju atom vodonika vezan za karbonilnu grupu i zato su otporniji na oksidaciju. Oni se oksiduju samo snažnim oksidacionim sredstvima koja imaju sposobnost cepanja veza ugljenik-ugljenik.
Spektroskopija uredi
Ketoni i aldehidi snažno apsorbuju u infracrvenom spektru blizu 1700 cm−1. Tačan položaj pika zavisi od supstituenata.
Dok 1H NMR spektroskopija generalno nije korisna za utvrđivanje prisustva ketona, 13C NMR spektri pokazuju signale nešto niže od 200 ppm, u zavisnosti od strukture. Takvi signali su obično slabi zbog odsustva nuklearnih Overhauzerovih efekata. Pošto aldehidi rezoniraju pri sličnim hemijskim pomacima, primenjuju se eksperimenti višestruke rezonance da bi se definitivno razlikovali aldehidi i ketoni.
Kvalitativni organski testovi uredi
Ketoni daju pozitivne rezultate u Brejdijevom testu, reakcijom sa 2,4-dinitrofenilhidrazinom dajući odgovarajući hidrazon. Ketoni se mogu razlikovati od aldehida davanjem negativnog rezultata sa Tolensovim reagensom ili sa Felingovim rastvorom. Metil ketoni daju pozitivne rezultate na jodoformnom testu.[11] Ketoni takođe daju pozitivne rezultate kada se tretiraju sa m-dinitrobenzenom u prisustvu razblaženog natrijum hidroksida dajući ljubičastu boju.
Sinteza uredi
Postoje mnogi metodi za pripremu ketona u industrijskim razmerama i akademskim laboratorijama. Ketone takođe na razne načine proizvode organizmi; pogledajte odeljak o biohemiji u nastavku.
U industriji najvažnija metoda verovatno uključuje oksidaciju ugljovodonika, često vazduhom. Na primer, milijarda kilograma cikloheksanona proizvede se godišnje aerobnom oksidacijom cikloheksana. Aceton se priprema vazdušnom oksidacijom kumena.
Za specijalizovane ili male organske sintetske primene, ketoni se često pripremaju oksidacijom sekundarnih alkohola:
- R2CH(OH) + O → R2C=O + H2O
Tipični jaki oksidansi (izvor „O“ u gornjoj reakciji) uključuju kalijum permanganat ili Cr(VI) jedinjenje. U blažim uslovima koriste se Des–Martinov perjodinan ili Mofat–Svern metode.
Razvijene su mnoge druge metode, primeri uključuju:[12]
- Hidrolizom geminalnih halida.[13]
- Hidratacijom alkina.[14] Takvi procesi se dešavaju preko enola i zahtevaju prisustvo kiseline i HgSO4. Kasnija enol-keto tautomerizacija daje keton. Ova reakcija uvek proizvodi keton, čak i sa terminalnim alkinom, jedini izuzetak je hidratacija acetilena, koji proizvodi acetaldehid.
- Od Vajnrebovih amida koristeći stehiometrijske organometalne reagense.
- Aromatični ketoni se mogu dobiti Fridel-Kraftsovom acilacijom,[15] srodnom Houben-Hešovom reakcijom,[16] i Frisovim preuređivanjem.[14]
- Ozonoliza i srodne sekvence dihidroksilacije/oksidacije cepaju alkene dajući aldehide ili ketone, u zavisnosti od načina supstitucije alkena.[17]
Reference uredi
- ^ IUPAC. „ketones”. Kompendijum hemijske terminologije (Internet izdanje).
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I izd.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th izd.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
- ^ Online Etymology Dictionary
- ^ Harper, Douglas. „ketone”. Online Etymology Dictionary.
- ^ The word "ketone" was coined in 1848 by the German chemist Leopold Gmelin. See: Leopold Gmelin, ed., Handbuch der organischen Chemie: Organische Chemie im Allgemeinen … (Handbook of organic chemistry: Organic chemistry in general … ), 4th ed., (Heidelberg, (Germany): Karl Winter, 1848), volume 1, p. 40. From page 40: "Zu diesen Syndesmiden scheinen auch diejenigen Verbindungen zu gehören, die als Acetone im Allegemeinen (Ketone?) bezeichnet werden." (To these syndesmides*, those compounds also seem to belong, which are designated as acetones in general (ketones?).") [*Note: In 1844, the French chemist Auguste Laurent suggested a new nomenclature for organic compounds. One of his new classes of compounds was "syndesmides", which were compounds formed by the combination of two or more simpler organic molecules (from the Greek σύνδεσμος (syndesmos, union) + -ide (indicating a group of related compounds)). For example, acetone could be formed by the dry distillation of metal acetates, so acetone was the syndesmide of two acetate ions. See: Laurent, Auguste (1844) "Classification chimique," Comptes rendus, 19 : 1089–1100 ; see especially p. 1097.
- ^ List of retained IUPAC names retained IUPAC names Link
- ^ McMurry John E. (1992). Fundamentals of Organic Chemistry (3rd изд.). Belmont: Wadsworth. ISBN 0-534-16218-5.
- ^ Evans, David A. (4. 11. 2005). „Evans pKa table” (PDF). Evans group website. Arhivirano iz originala (PDF) 19. 06. 2018. g. Pristupljeno 14. 6. 2018.
- ^ Smith, Michael B. (2013). March's Advanced Organic Chemistry (7th izd.). Hoboken, N.J.: Wiley. str. 314—315. ISBN 978-0-470-46259-1.
- ^ Mendham, J.; Denney, R. C.; Barnes, J. D.; Thomas, M.J.K.; Denney, R. C.; Thomas, M. J. K. (2000). Vogel's Quantitative Chemical Analysis (6th izd.). New York: Prentice Hall. ISBN 0-582-22628-7.
- ^ Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th izd.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
- ^ Marvel, C. S.; Sperry, W. M. (1928). „Benzophenone”. Organic Syntheses. 8: 26. doi:10.15227/orgsyn.008.0026.
- ^ a b Furniss, Brian; Hannaford, Antony; Smith, Peter; Tatchell, Austin (1996). Vogel's Textbook of Practical Organic Chemistry (5th izd.). London: Longman Science & Technical. str. 612—623, 976—977, 982—983. ISBN 9780582462366.
- ^ Allen, C. F. H.; Barker, W. E. (1932). „Desoxybenzoin”. Organic Syntheses. 12: 16. doi:10.15227/orgsyn.012.0016.
- ^ Gulati, K. C.; Seth, S.R.; Venkataraman, K. (1935). „Phloroacetophenone”. Organic Syntheses. 15: 70. doi:10.15227/orgsyn.015.0070.
- ^ Tietze, Lutz F.; Bratz, Matthias (1993). „Dialkyl Mesoxalates by Ozonolysis of Dialkyl Benzalmalonates: Dimethyl Mesoxalate”. Organic Syntheses. 71: 214. doi:10.15227/orgsyn.071.0214.
Spoljašnje veze uredi
- Mediji vezani za članak Keton na Vikimedijinoj ostavi

