Proton
U fizici, proton (grč. πρώτος [prótos — protos] — „prvi“) je subatomska čestica sa pozitivnim elementarnim naelektrisanjem od 1,6 × 10−19 kulona i masom od 938 MeV/c2 (1,6726231 × 10−27 kg, što je oko 1800 puta veća od mase elektrona).[4] Proton se generalno smatra stabilnom česticom, sa donjom granicom poluraspada od oko 1035 godina, i nije sigurno da li uopšte može da se raspadne. Pošto se ne zna da postoji neki fizički zakon zbog kog proton ne bi mogao da se raspadne, neke današnje teorije predviđaju stabilnost, a neke raspad protona.[5]
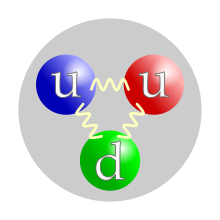 Kvarkni sadržaj protona. Dodela boja pojedinačnim kvarkovima je proizvoljna, ali sve tri boje moraju biti prisutne. Sile između kvarkova posredovane su gluonima. | |
| Klasifikacija | Barion |
|---|---|
| Kompozicija | 2 gornja kvarka (u), 1 donja kvarka (d) |
| Statistike | Fermionske |
| Interakcije | Gravitacija, elektromagnetna, slaba, jaka |
| Simbol | p, p+, N+, 1 1H+ |
| Antičestica | Antiproton |
| Teorije | Vilijam Praut (1815) |
| Otkriven | Uočen kao H+ zaslugom Eugena Goldstajna (1886). Ernest Raderford je identifikovao proton u drugim jezgrima (i imenovao ga) (1917–1920). |
| Masa | 1,67262192369(51)×10−27 kg[1] 1,007276466621(53) u[2] |
| Srednji poluživot | > 2,1×1029 godina (stabilan) |
| Naelektrisanje | +1 e 1,602176634×10−19 C[2] |
| Radijus naelektrisanja | 0,8414(19) fm[2][3] |
| Električni dipolni momenat | < 5,4×10−24 e⋅cm |
| Električna polarizabilnost | 1,20(6)×10−3 fm³ |
| Magnetni moment | 1,41060679736(60)×10−26 J⋅T−1[2] 2,79284734463(82) μN[2] |
| Magnetna polarizabilnost | 1,9(5)×10−4 fm³ |
| Spin | 1/2 |
| Izospin | 1/2 |
| Parnost | +1 |
| Kondenzovan | I(JP) = 1/2(1/2+) |
Proton, poput neutrona, spada u nukleone, odnosno čestice koje sačinjavaju jezgra atoma. Atomsko jezgro najrasprostranjenijeg izotopa vodonika čini samo jedan proton. Jezgra drugih atoma se sastoje iz protona i neutrona koje na okupu drži jaka nuklearna sila. Broj protona u jezgru definiše hemijski element i određuje hemijska svojstva atoma. Proton na osnovu svoje unutrašnje strukture spada u klasu bariona i sastoji se od dva Up ("gornja") kvarka i jednog Down ("donjeg") kvarka, koji se na okupu drže jakim nuklearnim silama preko gluona. Antičestica protona je antiproton, koji kao čestica ima sve karakteristike iste kao i proton, osim što mu je naelektrisanje suprotnog znaka, odnosno ima jedinično negativno naelektrisanje (kao elektron). U hemiji i biohemiji, termin proton može da se odnosi na vodonikov jon. U ovom kontekstu, donor protona je kiselina, a akceptor protona je baza.
Reč proton je izvedena iz grčke reči sa značenjem „prvi”, a ovo ime je jezgru vodonika dao Ernest Raderford 1920. Prethodnih godina, Raderford je otkrio da vodonikovo jezgro (poznato da je najlakše jezgro) može da se izvadi iz jezgara azota atomskim sudarima.[6] Protoni su, prema tome, bili kandidat za fundamentalnu česticu, a samim tim i gradivni blok azota i svih drugih težih atomskih jezgara.
Iako su protoni izvorno smatrani osnovnim ili elementarnim česticama, u savremenom standardnom modelu fizike čestica protoni su klasifikovani kao hadroni, poput neutrona, koji je isto tako nukleon. Protoni su kompozitne čestice sastavljene od tri valentna kvarta: dva gornja kvarka naboja +2/3e i jednog donjeg kvarka naboja –1/3e. Mase mirovanja kvarkova doprinose samo oko 1% mase protona.[7] Ostatak protonske mase nastaje zahvaljujući energiji vezivanja kvantne hromodinamike, koja uključuje kinetičku energiju kvarkova i energiju gluonskih polja koja vezuju kvarkove zajedno. Kako protoni nisu osnovne čestice, oni poseduju merljivu veličinu; srednji kvadratni koren poluprečnika naboja protona je oko 0,84–0,87 fm (ili 0,84×10−15 do 0,87×10−15 m).[8][9] Godine 2019, dve različite studije, koristeći različite tehnike, otkrile su da je radijus protona 0,833 fm, sa neizvesnošću od ±0,010 fm.[10][11]
Atomska teorija uredi
U atomskoj teoriji materije, atom se sastoji od atomskog jezgra oko koga kruže elektroni. Danas je generalno priznato mišljenje da se atomska jezgra svih hemijskih elemenata sastoji od pozitivno nabijenih protona i neutrona koji nemaju električni naboj. Čestice koje se nalaze u atomskom jezgru, to jest protoni i neutroni, zovu se zajedničkim imenom nukleoni (lat. nucleus: jezgra). Neutron ima masu gotovo jednaku masi protona. Proton je jezgro vodonikovog atoma, te mu je masa jednaka masi atoma vodonika. Broj protona u atomskom jezgru koji se zove atomski broj, jednak je njezinom električnom naboju i uvek odgovara rednom broju hemijskog elementa u periodnom sistemu. Dakle atomskim brojem određena je vrsta hemijskog elementa.
U neutralnom atomu broj elektrona što kruže oko jezgre jednak je broju protona u jezgru. Pozitivan naboj jednog protona jednako je velik kao negativan naboj elektrona. Godine 1869, ruski hemičar D. I. Mendeljejev otkrio je zakonitost ponavljanja hemijskih svojstva elemenata kod povećanja njihove atomske mase. On je tada sve poznate elemente poređao po rastućim atomskim masama jedan iznad drugoga i sastavio periodni sistem. Mendeljejev je dokazao da svaki hemijski element ima određen sastav atoma koji označava atomska masa i mesto u periodnom sistemu elemenata.
Broj protona P i neutrona N u jezgru određuje atomsku masu A određenog elementa, to jest:
i zove se maseni broj atoma. Na primer jezgro helijuma sastoji se od dva protona i dva neutrona. Prema tome je električni naboj jezgra i redni broj helijuma 2, a relativna atomska masa 4. Oko atomskog jezgra kruže negativno nabijeni elektroni, a broj elektrona jednak je broju protona u jezgru.
Za dati broj protona u jezgri mogu postojati različite količine neutrona. Dva atoma koji imaju isti broj protona, a različiti broj neutrona, imaju skoro ista hemijska svojstva i isti redni broj, ali različite atomske mase. Takvi elementi koji imaju isti redni broj, a različitu atomsku masu, zovu se izotopi. Tako na primer postoji hlor koji ima redni broj 17, to jest njegovo jezgro sadrži 17 protona, dok mu je atomska masa 35, što znači da jezgro njegovog atoma sadrži 18 neutrona (17 + 18 = 35). Međutim, postoji i hlor s atomskom masom 37, to jest jezgro njegovog atoma sadrži 20 neutrona (17 + 20 = 37). Običan hlor koji se nalazi u jedinjenjima u prirodi ima atomsku masu 35,46, što znači da je on smeša ta dva izotopa koji su u njemu zastupani u odnosu 3 : 1, to jest:
Prvi izotop hlora piše se simbolički 17Cl35, a drugi 17Cl37. Gornji broj uz hemijski simbol elementa znači relativnu atomsku masu tog elementa, a donji - broj protona u jezgru tog elementa, odnosno njegov redni broj. Vodonik ima tri izotopa: 1H1 običan vodonik, 1H2 teški vodonik ili deuterijum, i 1H3 tricijum.
Ovakvi izotopi nađeni su gotovo kod svih hemijskih elemenata. Tako uranijum, koji je važan za dobivanje nuklearne energije, ima 5 izotopa. Uranijum ima redni broj 92, a njegovi izotopi imaju atomske mase 234, 235, 237, 238 i 239. U prirodnom uranijumu najjače je zastupljen izotop s atomskom masom 238. Ima ga 137 puta više nego izotopa s atomskom masom 235. Ostalih njegovih izotopa ima još i manje. Izotopi se danas u znatnoj meri primenjuju u medicini, tehnici i privredi, a naročito su veoma važni u proizvodnji nuklearne energije. Odeljivanje izotopa vrši se centrifugiranjem, destilacijom, difuzijom i tako dalje.
Da se jezgro atoma koja se sastoji od pozitivno nabijenih protona ne bi raspalo, jer se istoimeni električni naboji međusobno odbijaju, deluju privlačne sile koje vladaju, između protona i neutrona. To su takozvane sile jezgra ili osnovne sile koje, iako su vrlo velike, deluju samo na vrlo malim razdaljinama, to jest na dimenzijama atomskog jezgra. Tumačenje tih sila se u današnje vreme ubraja u glavne probleme atomske fizike.[12]
Istorija uredi
Proton je 1918. otkrio Ernest Raderford. On je zapazio da pri bombardovanju gasovitog azota alfa česticama, svetlosni detektori pokazuju prisustvo vodonikovog jezgra. Raderford je zaključio da je jedino mesto odakle vodonik može da potiče - azot, i stoga azot mora sadržati vodonikovo jezgro. On je stoga zaključio da je vodonikovo jezgro, za koje je bilo poznato da ima atomski broj 1, elementarna čestica. Ovoj čestici je dao ime proton od grčke reči πρώτος [protos — protos] — „prvi“.
Tehnološke primene uredi
Poput drugih elementarnih čestica, proton poseduje spin. Ovo svojstvo je iskorišćeno u nuklearnoj magnetnoj rezonanciji (NMR spektroskopiji).
Vidi još uredi
Reference uredi
- ^ „2018 CODATA Value: proton mass”. The NIST Reference on Constants, Units, and Uncertainty. NIST. 20. 5. 2019. Pristupljeno 2019-05-20.
- ^ a b v g d đ e "2018 CODATA recommended values" https://physics.nist.gov/cuu/Constants/index.html
- ^ Pohl, Randolf; et al. (8. 7. 2010). „The size of the proton”. Nature. 466 (7303): 213—216. Bibcode:2010Natur.466..213P. PMID 20613837. S2CID 4424731. doi:10.1038/nature09250.
- ^ „What is Proton - Properties of Proton”. Nuclear Power (na jeziku: engleski). Pristupljeno 9. 10. 2019.
- ^ „Proton Decay Searches: Hyper-Kamiokande”. www.hyper-k.org. Pristupljeno 9. 10. 2019.
- ^ „proton | Definition, Mass, Charge, & Facts”. Encyclopedia Britannica. Pristupljeno 20. 10. 2018.
- ^ Cho, Adrian (2. 4. 2010). „Mass of the Common Quark Finally Nailed Down”. Science Magazine. American Association for the Advancement of Science. Pristupljeno 27. 9. 2014.
- ^ „Proton size puzzle reinforced!”. Paul Shearer Institute. 25. 1. 2013.
- ^ Antognini, Aldo; et al. (25. 1. 2013). „Proton Structure from the Measurement of 2S-2P Transition Frequencies of Muonic Hydrogen” (PDF). Science. 339 (6118): 417—420. Bibcode:2013Sci...339..417A. PMID 23349284. S2CID 346658. doi:10.1126/science.1230016. hdl:10316/79993. Arhivirano iz originala (PDF) 14. 03. 2020. g. Pristupljeno 12. 08. 2020.
- ^ Bezginov, N.; Valdez, T.; Horbatsch, M.; Marsman, A.; Vutha, A. C.; Hessels, E. A. (6. 9. 2019). „A measurement of the atomic hydrogen Lamb shift and the proton charge radius”. Science. 365 (6457): 1007—1012. Bibcode:2019Sci...365.1007B. ISSN 0036-8075. PMID 31488684. S2CID 201845158. doi:10.1126/science.aau7807.
- ^ Xiong, W.; Gasparian, A.; Gao, H.; Dutta, D.; Khandaker, M.; Liyanage, N.; Pasyuk, E.; Peng, C.; Bai, X.; Ye, L.; Gnanvo, K. (novembar 2019). „A small proton charge radius from an electron–proton scattering experiment”. Nature. 575 (7781): 147—150. Bibcode:2019Natur.575..147X. ISSN 1476-4687. OSTI 1575200. PMID 31695211. S2CID 207831686. doi:10.1038/s41586-019-1721-2.
- ^ Velimir Kruz: "Tehnička fizika za tehničke škole", "Školska knjiga" Zagreb, 1969.
Literatura uredi
- Macura, Slobodan; Radić-Perić, Jelena (2004). Atomistika. Beograd: Fakultet za fizičku hemiju Univerziteta u Beogradu/Službeni list. str. 499.