Злоћудни рак танког црева
Злоћудни рак танког црева један је од најређих карцинома, који се јавља у 4% свих карцинома гастроинтестиналног тракта.[1] Истраживање природне историје и прогнозе пацијената са карциномом танког црева ограничено је малим бројем случајева и хетерогеношћу типова тумора. Око 98% тумора танког црева чине аденокарциноми, карциноидни тумори, лимфоми, саркоми (најчешће леиомиосарком, а ређе ангиосарком или липосарком) и гастроинтестинални стромални тумори (ГИСТ). Сваки од ових подтипова тумора има своје специфично клиничко понашање и, стога, захтева другачији приступ лечењу.[2][3]
| Злоћудни рак танког црева | |
|---|---|
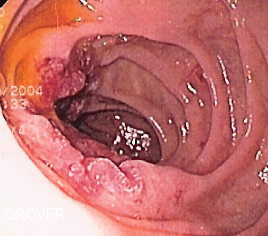 | |
| Рак дуодена | |
| Специјалности | онкологија, гастроентерологија |
Како се злочудне лезије танког црева често откривају када метастазирају на удаљена места или случајно (нпр на операцијикоја је индицирана за другу дијагнозу) или након опструкције црева, ови пацијенти често имају лошу прогнозу.
Историја уреди
Иако је злоћудни рак танког црева прилично ретка врста рака, први извештаји о овом тумору датирају од пре више од 250 година, када хе 1746. године немачки хирург Georg Erhard Hamberger описао случај тумора танког црева који је открио у дванаестопалачном цреву након перфорације црева.[4] Међутим, данас се чини вероватнијим да се заправо није радило о малигному танког црева, већ о перфорираном дуоденалном чиру.[5]
Један од првих описа тумора такође у дванаестопалачном цреву дао је Ђовани Батиста Моргањи у писму из 1861. године, који је можда дијагностикован пре 1833. године.
Даље описе овог ретког тумора дали су Chomel 1852. и Caillet 1876. године.[6] Прву серију случајева малигних неоплазми танког црева објавио је Лајхтенштајн 1876. године. Потом је Hearteaux 1899. године објавио серију случајева бенигних тумора, а Веснер 1883. описао лејомиосарком црева.[5]
Прву успешну ресекцију тумора танког црева у илеуму извео је W. Fleinera 1885. године.[5]
Епидемиологија уреди
Америчко друштво за рак процењује 11.790 нових случајева и 1.960 смртних случајева од рака танког црева у Сједињеним Америчким Државама 2022. године.[7]
Генерално, преваленција рака танког црева је нижа у Азији и у мање индустријализованим земљама него у западним земљама. Поред тога, неколико болничких серија показује да док аденокарциноми чине већину карцинома танког црева у развијеним земљама, лимфоми преовлађују у мање развијеним земљама.
Популационе студије у Сједињеним Америчким Државама сугеришу нешто веће стопе преваленције рака танког црева код црнаца него код белаца. Према једној студији, црнци имају скоро двоструко већу инциденцу карцинома од белаца (10,6 према 5,6 на милион становника).[8]
Мушкарци представљају благу превагу нових случајева (53%) у поређењу са женама (47%).[7]
Преваленција карцинома танког црева има тенденцију да расте са годинама, са просечном старошћу при постављању дијагнозе од приближно 60 година. Аденокарциноми, више од других хистолошких подтипова, имају тенденцију да се дијагностикују код нешто старијих пацијената.[9]
Етиопатогенеза уреди
Ћелијска класификација рака танког црева уреди
Тумори који се јављају у танком цреву укључују следеће:[10]
- Аденокарцином (у већини случајева).
- Лимфом (неуобичајен), који је обично не-Ходџкиновог типа.
- Сарком (најчешће леиомиосарком и ређе ангиосарком или липосарком).
- Неуроендокрини тумори.
- Гастроинтестинални стромални тумори.
Приближно 25% до 50% примарних малигних тумора у танком цреву су аденокарциноми, а већина се јавља у дуоденуму.[11] Карциноми танког црева могу се јавити синхроно или метахроно на више места.
Леиомиосаркоми се најчешће јављају у илеуму.[10]
Око 20% малигних лезија танког црева су неуроендокрини тумори, који се чешће јављају у илеуму него у дуоденуму или јејунуму и могу бити вишеструки.[10]
Неуобичајено је да се малигни лимфом нађе као усамљена лезија танког црева.[10]
| Примарни тумор - Т карактеристика | |
| Тк | Примарни тумор се не може проценити |
| Т0 | Нема примарног тумора |
| ово | Рак ин ситу |
| Т1а | Тумор се инфилтрира у ламину проприју |
| Т1б | Тумор инфилтрира субмукозу |
| Т2 | Тумор продире у мишић |
| Т3 | Тумор продире у субсерозни слој или у ткива која окружују мукозу мускулариса на местима где црево није прекривено перитонеумом; инфилтрација <2 cm |
| Т4 | Перфорација висцералног перитонеума или директна инвазија других органа или структура, укључујући другу петљу танког црева, мезентеријум или ретроперитонеални простор >2 cm, или трбушни зид; за туморе дуоденума, инфилтрацију панкреаса или жучи |
| Захватање околних лимфних чворова - карактеристика Н | |
| Нк | Околни лимфни чворови се не могу проценити |
| Н0 | У оближњим лимфним чворовима нема метастаза |
| Н1 | Метастазе присутне у 1-3 лимфна чвора |
| Н2 | Метастазе присутне у ≥4 лимфна чвора |
| Удаљене метастазе – карактеристика М | |
| Мк | Не може се утврдити присуство удаљених метастаза |
| М0 | Нема удаљених метастаза |
| М1 | Присутне удаљене метастазе |
| Степен напредовања | Т карактеристика | Н карактеристика | М карактеристика |
| 0 | Тис | Т0 | М0 |
| I | Т1, Т2 | Н0 | М0 |
| II | Т3 | Н0 | М0 |
| IIБ | Т4 | Н0 | М0 |
| IIIА | сваки Т | Н1 | М0 |
| IIIБ | сваки Т | Н2 | М0 |
| IV | сваки Т | сваки н | М1 |
Фактори ризка уреди
Генетски фактори ризика уреди
Пацијенти са породичном аденоматозном полипозом развијају више аденома у танком цреву и дебелом цреву који могу довести до аденокарцинома.[13] После дебелог црева, дуоденум је најчешће место аденокарцинома. Студија болнице Џон Хопкинса из 1993. године, коју су спровели њени сарадници, открила је да пацијенти са породичном аденоматозном полипозом имају релативни ризик од више од 300 за дуоденални аденокарцином, али без повишеног ризика за рак желуца или недуоденалног карцинома танког црева.[14] Молекуларно-генетичке студије дуоденалних полипа код пацијената са породичном аденоматозном полипозом из 1997. године открила је високу учесталост прекомерне експресије п53 код диспластичних аденома, иако је учесталост ТП53 а мутације гена х-рас биле много ниже.[15]
Поред колоректалног карцинома, пацијенти са наследним неполипозним колоректалним карциномом такође развијају карцином ендометријума, желуца, танког црева, горњег уринарног тракта и карцинома јајника. Доживотни ризик од аденокарцинома танког црева код пацијената са наследним неполипозним колоректалним карциномом је 1-4%, што је више од 100 пута више од ризика у општој популацији.[16] Аденокарциноми танког црева код особа са наследним неполипозним колоректалним карциномом су прилично равномерно распоређени по танком цреву. Јављају се у млађој доби и изгледа да имају бољу прогнозу од спорадичних карцинома танког црева. Најчешћи мутирани гени у заметној линији пацијената са наследним неполипозним колоректалним карциномом су ХМЛХ1 и ХМСХ2, који су укључени у поправку неусклађености ДНК.[16]
Фактори ризика животне средине уреди
Студија из 1977. године открила је да је унос животињских масти у корелацији са раком танког црева.[17] Друга студија, 1993. године коју су спровели Чоу и сарадници, известила је да конзумација црвеног меса и сољу или димљене хране повећава ризик од рака танког црева 2-3 пута.[18]
Студије из 1994. године које су спровели Чен и сарадниици откриле су повезаност између пушења и аденокарцинома танког црева и између конзумирања алкохола и аденокарцинома танког црева, али то није потврђено у другим студијама.[19]
Предиспонирајућа медицинска стања уреди
Процењује се да је релативни ризик од аденокарцинома танког црева између 15 и више од 100 код пацијената са Кроновом болешћу. За разлику од већине аденокарцинома танког црева, тумори повезани са Кроновом болешћу генерално се јављају у илеуму, што одражава дистрибуцију Кронове болести. Ризик од аденокарцинома почиње тек најмање 10 година након појаве Кронове болести, а аденокарцином се обично јавља више од 20 година након тога.[16]
Чини се да пацијенти са целијакијом имају повећан ризик од лимфома танког црева и аденокарцинома. Истраживање одраслих пацијената са целијакијом у САД из 2001. које су спровели Грин и сарадници открило је релативни ризик од 300 за развој лимфома и 67 за развој аденокарцинома.[16] Чини се да аденокарциноми танког црева повезани са целијакијом имају повећану инциденцу поправке дефектне неусклађености ДНК у поређењу са онима који нису повезани са целијакијом и такође су повезани са ранијом фазом дијагнозе и бољом прогнозом.[20]
Клиничка слика уреди
Рак танког црева је обично асимптоматски у својим раним фазама, али више од 90% пацијената на крају развије симптоме како болест напредује. Ово, одражава узнапредовалу болест. Због неспецифичне природе симптома, често се јавља значајно кашњење између појаве симптома и дијагнозе, у просеку 6-8 месеци.
Мучнина, повраћање и опструкција црева су уобичајени симптоми. Половина ових пацијената се подвргава хитној операцији због опструкције црева. Бол у стомаку и губитак тежине компликују клиничку слику; крварење је ређе.
Сматра се да су аденокарциноми чешће повезани са болом и опструкцијом у поређењу са саркомима и карциноидима. Гастроинтестинални стромални тумори ( ГИСТ) се чешће јављају као акутно крварење у гастроинтестиналном тракту.
Диференцијална дијагноза уреди
У диференцијалној дијагнози рак танког црева требало би имати у виду следеће болести и стања:[21]
- Ампуларни карцином
- Бенигне неоплазме танког црева
- Туморе жучних канала
- Хронични гастритис
- Рак дебелог црева
- Кронову болест
- Рак желуца
- Леиомиосарком црева
- Интестинални полипоидни аденом
- Синдром иритабилног црева
- Рак панкреаса
- Пептичку улкусну болест
Терапија уреди
Основа лечења аденокарцинома и леиомиосаркома је радикална хируршка ресекција. Ако је лезија нересектабилна, опције лечења су хируршки бајпас опструкције и палијативна терапија зрачењем. За локално рекурентну болест, опције укључују операцију, палијативну терапију зрачењем, палијативну хемотерапију[22] и клиничка испитивања која процењују начине побољшања локалне контроле, као што је употреба терапије зрачењем са радиосензибилизаторима са или без системске хемотерапије.[23]
Хируршка терапија уреди
Хируршка ресекција пружа једину наду за излечење пацијенте са аденокарциномима и саркомима танког црева. Ово је могуће код отприлике две трећине пацијената са аденокарциномом. Преостали имају неоперабилну болест као резултат екстензивне локалне болести или метастаза у регионалне лимфне чворове, јетри или перитонеум.[23]
Пацијенти са лезијама у проксималном дуоденуму, укључујући и оне у периампуларном региону, треба да се подвргну панкреатикодуоденектомији, која сада има оперативну стопу морталитета мању од 5%. Неколико студија је показало да пацијенти који су подвргнути ресекцији имају побољшану 5-годишњу стопу преживљавања од 40-60%.[23]
Хируршка интервенција је индикована за палијацију код пацијената са симптоматском узнапредовалом болешћу, као што је опструкција црева. Тумори илеума имају већу вероватноћу да развију опструкцију црева него тумори јејуна. Хитна операција за ове пацијенте ублажава опструкцију, али онемогућава потпуну и негативну ресекцију маргине.
Тумори у дисталном дванаестопалачном цреву, јејунуму или илеуму треба да буду ресецирани са широким ивицама; тумори близу илеоцекалне валвуле могу захтевати десну хемиколектомију.
Метастазе у лимфним чворовима су ретке, па се због тога не препоручује опсежна дисекција лимфних чворова. Чини се да ресекција продужава преживљавање, али је типичан рецидив са широко метастатском болешћу.
Опструкција жучи може бити резултат компресије екстрахепатичног заједничког жучног канала периампуларним или проксималним тумором дуоденума. Стентирање жучи путем ендоскопске ретроградне холангиопанкреатографије или трансхепатичне билијарне дренаже може се извршити ако је изводљиво.[23]
Хемотерапија уреди
Иако хируршка ресекција остаје примарна компонента лечења, удаљени рецидиви су чести након хируршке ресекције, што указује на улогу адјувантне системске терапије. Хемотерапија је повезана са побољшаним дугорочним преживљавањем и бројни докази подржавају употребу адјувантне хемотерапије, посебно код пацијената са захваћеним регионалним лимфним чворовима.[24]
Хемотерапијски лекови који се могу користити у лечењу укључују:[23]
Радиотерапија уреди
Иако се адјувантном радиотерапијом након операције аденокарцинома или саркома танког црева не постиже преживљавање, радиотерапија се користи као палијативна процедура за ублажавање болова или опструктивних симптома код пацијената са узнапредовалом болешћу.[22] Такође, радиотерапија може бити од користи за контролу хроничног губитка крви узрокованог тумором.[23]
Прогноза уреди
Аденокарциноми уреди
Стопе петогодишњег преживљавања код злоћудног аденокарцинома танког црева (који је најчешћи хистолошки тип малигнитета танког црева у Сједињеним Америчким Државама) по стадијуму су следеће:[28]
- Прва фаза - 70%
- Друга фаза - 55%
- Трећа фаза - 30%
- Четврта фаза - 5-10%
Укупна стопа преживљавања од 5 година за ресектабилни аденокарцином је 20%.[1]
Студија која је упоређивала исходе за 2.123 пацијента са аденокарциномом танког црева и 248.862 пацијента са карциномом дебелог црева показала је да је прогноза за аденокарцином танког црева лошија од оне за рак дебелог црева, и да само операција побољшава преживљавање. За разлику од рака дебелог црева, хемотерапија није побољшала опште или специфично преживљавање, без обзира на стадијум рака. Предиктори лошег преживљавања укључивали су старију популацију, црну расу, узнапредовали стадијум, лошу диференцијацију тумора, висок индекс коморбидитета и дисталну локацију.[29]
Саркоми уреди
Петогодишња стопа преживљавања за ресектабилни леиомиосарком, најчешћи примарни сарком танког црева, је приближно 50%.[1] Негативне хируршке маргине после операције побољшавају прогнозу. Интестинално крварење је уобичајено код саркома танког црева и може захтевати трансфузију и хируршку интервенцију.
Извори уреди
- ^ а б в „Small Intestine Cancer Treatment (PDQ®)–Health Professional Version - NCI”. www.cancer.gov (на језику: енглески). 2023-01-13. Приступљено 2023-01-22.
- ^ Rose, D. M.; Hochwald, S. N.; Klimstra, D. S.; Brennan, M. F. (1996). „Primary duodenal adenocarcinoma: A ten-year experience with 79 patients”. Journal of the American College of Surgeons. 183 (2): 89—96. PMID 8696551.
- ^ North, J. H.; Pack, M. S. (2000). „Malignant tumors of the small intestine: A review of 144 cases”. The American Surgeon. 66 (1): 46—51. PMID 10651347. S2CID 22578850. doi:10.1177/000313480006600110..
- ^ Hamberger G.E., Propempticum auspicale quo dissertationem solennem ... indicit et de ruptura intestini duodeni disserit, Jena 1746.
- ^ а б в Olson, James Stuart (1989). The History of Cancer: An Annotated Bibliography (на језику: енглески). ABC-CLIO. ISBN 978-0-313-25889-3.
- ^ Figueira-Coelho, João; Lourenço, Sofia; Costa, Michele; Mendonça, Paula; Murinello, António; Neta, Jorge (2009). „Blood loss anemia due to adenocarcinoma of the jejunum: Case report and review of the literature”. Cases Journal. 2: 6237. PMC 2769274 . PMID 19918564. doi:10.4076/1757-1626-2-6237..
- ^ а б Anzidei, M.; Napoli, A.; Zini, C.; Kirchin, M. A.; Catalano, C.; Passariello, R. (август 2011). „Malignant tumours of the small intestine: A review of histopathology, multidetector CT and MRI aspects”. Br J Radiol. 84 (1004): 677—690. PMC 3473441 . PMID 21586504. doi:10.1259/bjr/20673379.
- ^ Haselkorn, T.; Whittemore, A. S.; Lilienfeld, D. E. (септембар 2005). „Incidence of small bowel cancer in the United States and worldwide: geographic, temporal, and racial differences”. Cancer Causes Control. 16 (7): 781—7. PMID 16132788. S2CID 12843608. doi:10.1007/s10552-005-3635-6..
- ^ Chow, J. S.; Chen, C. C.; Ahsan, H.; Neugut, A. I. (1996). „A population-based study of the incidence of malignant small bowel tumours: SEER, 1973-1990”. Int J Epidemiol. 25 (4): 722—8. PMID 8921448. doi:10.1093/ije/25.4.722.
- ^ а б в г „Small Intestine Cancer Treatment (PDQ®)–Health Professional Version - NCI”. www.cancer.gov (на језику: енглески). 2023-01-13. Приступљено 2023-01-22.
- ^ Small Intestine. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp. 221–34.
- ^ Qubaiah, O.; Devesa, S. S.; Platz, C. E.; Huycke, M. M.; Dores, G. M. (2010). „Small Intestinal Cancer: a Population-Based Study of Incidence and Survival Patterns in the United States, 1992 to 2006”. Cancer Epidemiology, Biomarkers & Prevention. 19 (8): 1908—1918. ISSN 1055-9965. PMC 2919612 . PMID 20647399. doi:10.1158/1055-9965.EPI-10-0328 .
- ^ Bhalla, A.; Zulfiqar, M.; Weindel, M.; Shidham, V. B. (децембар 2013). „Molecular diagnostics in the neoplasms of small intestine and appendix”. Clin Lab Med. 33 (4): 861—6. PMID 24267190. doi:10.1016/j.cll.2013.08.007.
- ^ Offerhaus, G. J.; Giardiello, F. M.; Krush, A. J.; Booker, S. V.; Tersmette, A. C.; Kelley, N. C.; Hamilton, S. R. (јун 1992). „The risk of upper gastrointestinal cancer in familial adenomatous polyposis”. Gastroenterology. 102 (6): 1980—2. PMID 1316858. doi:10.1016/0016-5085(92)90322-P.
- ^ Kashiwagi, H.; Spigelman, A. D.; Talbot, I. C.; Debinski, H. S.; McKie, A. B.; Lemoine, N. R.; Phillips, R. K. (јун 1997). „P53 and K-ras status in duodenal adenomas in familial adenomatous polyposis”. Br J Surg. 84 (6): 826—9. PMID 9189100..
- ^ а б в г „Malignant Neoplasms of the Small Intestine: Practice Essentials, Pathophysiology, Etiology”. 2022-05-18.
- ^ Lowenfels, Albert B.; Sonni, Ashok (1977). „Distribution of small bowel tumors”. Cancer Lett. 3 (1–2): 83—6. PMID 890689. doi:10.1016/s0304-3835(77)94394-4.
- ^ Chow, Wong -Ho; Linet, Martha S.; McLaughlin, Joseph K.; Hsing, Ann W.; Co Chien, Harvey T.; Blot, William J. (1993). „Risk factors for small intestine cancer”. Cancer Causes Control. 4 (2): 163—9. PMID 8481495. S2CID 23880452. doi:10.1007/BF00053158..
- ^ Bennett, C. M.; Coleman, H. G.; Veal, P. G.; Cantwell, M. M.; Lau, C. C.; Murray, L. J. (јун 2015). „Lifestyle factors and small intestine adenocarcinoma risk: A systematic review and meta-analysis” (PDF). Cancer Epidemiol. 39 (3): 265—73. PMID 25736860. S2CID 29984604. doi:10.1016/j.canep.2015.02.001.
- ^ Potter, D. D.; Murray, J. A.; Donohue, J. H.; Burgart, L. J.; Nagorney, D. M.; Van Heerden, J. A.; Plevak, M. F.; Zinsmeister, A. R.; Thibodeau, S. N. (2004-10-01). „The role of defective mismatch repair in small bowel adenocarcinoma in celiac disease”. Cancer Res. 64 (19): 7073—7. PMID 15466202. S2CID 27723256. doi:10.1158/0008-5472.CAN-04-1096..
- ^ „Malignant Neoplasms of the Small Intestine Differential Diagnoses”. emedicine.medscape.com (на језику: енглески). Приступљено 2023-01-22.
- ^ а б Ecker, B. L.; McMillan, M. T.; Datta, J.; Lee, M. K.; Karakousis, G. C.; Vollmer Jr, C. M.; Drebin, J. A.; Fraker, D. L.; Roses, R. E. (2017-05-15). „Adjuvant chemotherapy versus chemoradiotherapy in the management of patients with surgically resected duodenal adenocarcinoma: A propensity score-matched analysis of a nationwide clinical oncology database”. Cancer. 123 (6): 967—976. PMID 28263387. S2CID 3620622. doi:10.1002/cncr.30439.
- ^ а б в г д ђ „Malignant Neoplasms of the Small Intestine Treatment & Management: Approach Considerations, Medical Care, Surgical Care”. 2022-05-18.
- ^ Ecker, B. L.; McMillan, M. T.; Datta, J.; Mamtani, R.; Giantonio, B. J.; Dempsey, D. T.; Fraker, D. L.; Drebin, J. A.; Karakousis, G. C.; Roses, R. E. (2016-03-01). „Efficacy of adjuvant chemotherapy for small bowel adenocarcinoma: A propensity score-matched analysis”. Cancer. 122 (5): 693—701. PMID 26717303. S2CID 20147210. doi:10.1002/cncr.29840..
- ^ Jigyasu, D.; Bedikian, A. Y.; Stroehlein, J. R. (1984-01-01). „Chemotherapy for primary adenocarcinoma of the small bowel”. Cancer. 53 (1): 23—5. PMID 6690001. S2CID 27255895. doi:10.1002/1097-0142(19840101)53:1<23::AID-CNCR2820530106>3.0.CO;2-U..
- ^ Ouriel, Kenneth; Adams, James T. (јануар 1984). „Adenocarcinoma of the small intestine”. Am J Surg. 147 (1): 66—71. PMID 6691554. doi:10.1016/0002-9610(84)90036-9..
- ^ Crawley, C.; Ross, P.; Norman, A.; Hill, A.; Cunningham, D. (август 1998). „The Royal Marsden experience of a small bowel adenocarcinoma treated with protracted venous infusion 5-fluorouracil”. Br J Cancer. 78 (4): 508—10. PMC 2063096 . PMID 9716035. doi:10.1038/bjc.1998.523..
- ^ American Joint Committee on Cancer. Small Intestine. AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer; 2017. 221-234.
- ^ Young, J. I.; Mongoue-Tchokote, S.; Wieghard, N.; Mori, M.; Vaccaro, G. M.; Sheppard, B. C.; Tsikitis, V. L. (април 2016). „Treatment and Survival of Small-bowel Adenocarcinoma in the United States: A Comparison With Colon Cancer”. Dis Colon Rectum. 59 (4): 306—15. PMID 26953989. S2CID 37437859. doi:10.1097/DCR.0000000000000562..
Спољашње везе уреди
| Класификација |
|---|
| Молимо Вас, обратите пажњу на важно упозорење у вези са темама из области медицине (здравља). |