Rh систем крвних група
Rh систем крвних група је систем крвних група код човјека. Садржи протеине на површини црвених крвних зрнаца. То је други по важности систем крвних група, послије AB0 система крвних група. Rh систем крвних група састоји се од 49 дефинисаних антигена крвних група,[1] међу којима је најважније пет антигена: D, C, c, E и e. Не постоји d антиген. Rh(D) статус особе се обично описује позитивним или негативним суфиксом након типа AB0 типа (нпр. неко ко је А+ има антиген А и антиген Rh(D), док неко ко је А- нема антиген Rh(D)). Изрази Rh фактор, Rh позитиван и Rh негативна, односе се само на антиген Rh(D). Антитијела на Rh антигене могу довести до реакције хемолитичке трансфузије, а антитијела на Rh(D) и Rh антигене дају значајан ризик од хемолитичке болести фетуса и новорођенчета.
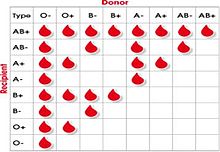
Номенклатура уреди
| Фишер—Рејс | Винер |
|---|---|
| Dce | R0 |
| DCe | R1 |
| DcE | R2 |
| DCE | RZ |
| dce | r |
| dCe | r' |
| dcE | r″ |
| dCE | ry |
Rh систем крвних група има два низа номенклатура: први су развили Роналд Фишер и Роберт Расел Рејс, а други Александар Соломон Винер. Оба система одражавали су алтернативне теорије насљеђивања. Фишер—Рејсов систем, који је данас чешћи, користи CDE номенклатуру. Овај систем се заснивао на теорији по којој одвојени ген контролише производ сваког одговарајућег антигена (нпр. „D ген” производ D антиген итд.). Међутим, d ген је био хипотетичан, а не стваран.
Винеров систем користи Rh—Hr номенклатуру. Овај систем се заснивао на теорији по којој је постојао један ген у једном локусу на свакој од двије копије хромозома 1, сваки доприносећи стварању вишеструких антигена. У овој теорији, ген R1 треба створити „крвне факторе” Rh0, rh′ и rh″ (што одговара савременој номенклатури D, C и E антигена) и ген r који ствара hr′ и hr″ (што одговара савременој номенклатури c и e антигена).[3]
Нотације двије теорије користе се наизмјенично у складиштењу резервне крви (нпр. Rho(D) значи RhD+). Винерова нотација је сложенија и гломазнија за рутинску употребу. Будући да је једноставније објаснити, Фишер—Рејсова теорија постала је чешће коришћења.
ДНК тестирање показало је да су обје дјелимично тачне: у ствари постоје два повезана гена, RHD ген који производи једну имунолошку специфичност (анти-D) и RHCE ген са вишеструким специфичностима (анти-C, анти-c, анти-E и анти-e). Тако се показало да је Винеров постулат према ком ген може имати више специфичности (нешто у шта се првобитно није вјеровало) тачан. С друге стране, Винерова теорија према којој постоји само један ген показала се нетачном, као и Фишер—Рејсова теорије да постоје три гена, а не два. CDE нотација која се користи у Фишер—Рејсовој номенклатури понекад се преуређује у DCE како би тачније представила колокацију C и E кодирања RhCE гена и олакшала интерпретацију.
Историја уреди
Израз „Rh” првобитно је био скраћени за „резус фактор”. Открили су га 1937. Карл Ландштајнер и Александар С. Винер, који су у то вријеме вјеровали да је то сличан антиген који је пронађен у црвеним крвним зрнцима резус макаке. Накнадно се сазнало да људски фактор није идентичан фактору резус макакија, али до тада су „резус група” и слични изрази већ постали широко распрострањени. Стога, без обзира на то што је погрешан назив, изрази је преживио (нпр. резус систем крвне групе и застарјели изрази резус фактор, резус позитиван и резус негативан — сва три израза се заправо односе засебно и само на Rh D фактор и због тога су обмањујући када се користе неизмјењени). У савременој пракси се користи „Rh” као израз умјесто „резус (нпр. „Rh група”, „Rh фактор”, „Rh D” итд.).
Значај њиховог открића није био одмах очигледан и схваћен је тек 1940, након накнадних налаза Филипа Левина и Руфуса Стетсона.[4] Серум који је довео до открића преизведен је имунизацијом зечева црвеним крвним зрнцима из резус макакија. Они су антиген који је индуковао ову имунизацију означили као Rh фактор који указује на то да је резус крв коришћена за производњу серума.[5]
Левин и Стетсон су 1939. објавили извјештај о првом случају клиничке посљедице непрепознатог Rh фактора, хемолитичке реакције трансфузије и хемолитичке болести новорођенчета у његовом најтежем облику.[6] Препознато је да се серум пријављене жене аглутинира са црвеним крвним зрнцима око 80% људи, иако се подударају тада познате групе, посебно AB0. Када је описан, овом аглутинину није дато име. Ландштајнер и Винер су 1940. то повезали са својим ранијим открићем, извјештавајући о серуму који је реаговао са око 85% различитих људских црвених крвним зрнаца.[4]
Пацијент из групе O др Пола из Ирвингтона у Њу Џерзију, родила је нормално дијете 1931:[7] ову трудноћу пратио је дуги период стерилности. Друга трудноћа (април 1941) довела је до тога да је новорођенче патило од жутице. Трећи анти-Rh серум групе O постао је доступан у мају 1941. године.[8]
На основу серолошких сличности, Rh фактор је касније коришћен и за антигене, и анти-Rh за антитијела, пронађена код људи, попут оних која су претходно описали Левин и Стетсон. Иако су разлике између ова два серума показане већ 1942. и јасно исказане 1963, већ широко коришћен израз „Rh” задржао се за клинички опис људских антитијела која се разликују од оних која се односе на резус макакије. Овај стварни фактор пронађен у резус макакијима класификован је у Ландштајнер-Винеровом систему антигена (антиген LW, антитијело анти-LW).[9][10]
Препознато је да је Rh фактор само један у систему различитих антигена. На основу различитих модела генетског насљеђа, развије су двије различите терминологије; обје су и даље у употреби.
Клинички значај високо имунизујућег антигена D (тј. Rh фактора) убрзо је схваћен. Неки кључни принципи требали су препознати његову важност за трансфузију крви (укључујући поуздане дијагностичке тестове), хемолитичку болест новорођенчета (укључујући замјенску трансфузију) и што је врло важно превенцију истих скринингом и профилаксом.
Откриће феталне ДНК без ћелија у циркулацији мајке од стране Холцгријева и осталих довело је до неинвазивног генотиповања феталних Rh гена у многим земљама.
Антигени уреди
Протеини који носе Rh антигене су трансмембрански протеини, чија структура сугерише да су то јонски канали.[11] Главни антигени су D, C, E, c и e, који су кодирани са два сусједна генска локуса, RHD геном који кодира RhD протеин са D антигеном (и варијантама)[12] и RHCE ген који кодира протен RhCE протеин са C, E, c и e антигени (и варијантама).[12]
2. Rh- крвна ћелија.
3. Антигени на Rh+ крвној ћелији који је чине позитивном. Антигени омогућавају позитивном крвним ћелијама да се прикаче за одређена антитијела.
Rh фенотипи се лако идентификују кроз присуство или одсуство Rh површинских антигена. Као што се може видјети у доњој табели, већина Rh фенотипова може настати из неколико различитих Rh генотипова. Тачан генотип било ког појединца може се идентификовати само ДНК анализом. Што се тиче лијечења пацијената, обично је само фенотип од клиничког значаја како би се осигурало да пацијент није изложен антигену на који ће вјероватно развити антитијела. На основну статистичке расподјеле генотипова у мјесту поријекла пацијента, може се нагађати о вјероватном генотипу.
R0 (cDe или Dce) данас је најчешћи у Африци. Стога се у раним анализама крвних група често претпостављало да је алел типичан за популације на континенту; нарочито у подсахарском дијелу. Рад из 1963. сугерише да су високе фреквенције R0 вјероватно карактеристичне за древне јудејске Јевреје, који су емигрирали из Египта прије њиховог ширење по Средоземљу и Европи[13] на основу високог постотка R0 међу сефардским и ашкенашким Јеврејима у поређењу са старосједелачком популацијом Европе и релативна генетска изолација Ашкеназа. Међутим, новије студије су утврдиле учесталост R0 од само 24,3 међу неким афроазијским говорним групама на Рогу Африке,[14] као и веће фреквенције R0 међу неким другим афроазијским говорним групама у сјеверној Африци (37,3)[15] и међу неким Палестинцима у Леванту (30,4).[16]
| Фенотип изражен на ћелији | Генотип изражен у ДНК | Преваленција (%) | |
|---|---|---|---|
| Фишер—Рејсова нотација | Винерова нотација | ||
| D+ C+ E+ c+ e+ (RhD+) | Dce/DCE | R0RZ | 0,0125 |
| Dce/dCE | R0rY | 0,0003 | |
| DCe/DcE | R1R2 | 11,8648 | |
| DCe/dcE | R1r″ | 0,9992 | |
| DcE/dCe | R2r′ | 0,2775 | |
| DCE/dce | RZr | 0,1893 | |
| D+ C+ E+ c+ e− (RhD+) | DcE/DCE | R2RZ | 0,0687 |
| DcE/dCE | R2rY | 0,0014 | |
| DCE/dcE | RZr″ | 0,0058 | |
| D+ C+ E+ c− e+ (RhD+) | DCe/dCE | R1rY | 0,0042 |
| DCE/dCe | RZr′ | 0,0048 | |
| DCe/DCE | R1RZ | 0,2048 | |
| D+ C+ E+ c− e− (RhD+) | DCE/DCE | RZRZ | 0,0006 |
| DCE/dCE | RZrY | < 0,0001 | |
| D+ C+ E− c+ e+ (RhD+) | Dce/dCe | R0r′ | 0,0505 |
| DCe/dce | R1r | 32,6808 | |
| DCe/Dce | R1R0 | 2,1586 | |
| D+ C+ E− c− e+ (RhD+) | DCe/DCe | R1R1 | 17,6803 |
| DCe/dCe | R1r′ | 0,8270 | |
| D+ C− E+ c+ e+ (RhD+) | DcE/Dce | R2R0 | 0,7243 |
| Dce/dcE | R0r″ | 0,0610 | |
| DcE/dce | R2r | 10,9657 | |
| D+ C− E+ c+ e− (RhD+) | DcE/DcE | R2R2 | 1,9906 |
| DcE/dcE | R2r″ | 0,3353 | |
| D+ C− E− c+ e+ (RhD+) | Dce/Dce | R0R0 | 0,0659 |
| Dce/dce | R0r | 1,9950 | |
| D− C+ E+ c+ e+ (RhD−) | dce/dCE | rrY | 0,0039 |
| dCe/dcE | r′r″ | 0,0234 | |
| D− C+ E+ c+ e− (RhD−) | dcE/dCE | r″rY | 0,0001 |
| D− C+ E+ c− e+ (RhD−) | dCe/dCE | r′rY | 0,0001 |
| D− C+ E+ c− e− (RhD−) | dCE/dCE | rYrY | < 0,0001 |
| D− C+ E− c+ e+ (RhD−) | dce/dCe | rr′ | 0,7644 |
| D− C+ E− c− e+ (RhD−) | dCe/dCe | r′r′ | 0,0097 |
| D− C− E+ c+ e+ (RhD−) | dce/dcE | rr″ | 0,9235 |
| D− C− E+ c+ e− (RhD−) | dcE/dcE | r″r″ | 0,0141 |
| D− C− E− c+ e+ (RhD−) | dce/dce | rr | 15,1020 |
- Подаци узети из студије спроведене 1948. на узорку од 2000 људи у Уједињеном Краљевству..[17]
| Rh фенотип | CDE | Пацијенти (%) | Даваоци (%) |
|---|---|---|---|
| R1r | CcDe | 37,4 | 33,0 |
| R1R2 | CcDEe | 35,7 | 30,5 |
| R1R1 | CDe | 5,7 | 21,8 |
| rr | ce | 10,3 | 11,6 |
| R2r | cDEe | 6,6 | 10,4 |
| R0R0 | cDe | 2,8 | 2,7 |
| R2R2 | cDE | 2,8 | 2,4 |
| rr″ | cEe | — | 0,98 |
| RZRZ | CDE | — | 0,03 |
| rr′ | Cce | 0,8 | — |
Rh антитијела уреди
Rh антитијела су IgG антитијела која се добијају излагањем Rh+ крви (обично или трудноћом или трансфузијом крвних деривата). Антиген D је најимуногенији од свих не-AB0 антигена. Приближно 80 особа које су D- и изложене су само једној D+ јединици произвешће антитијело анти-D. Постотак алоимунизације је значајно смањен код пацијената који активно губе крв.[19]
Сва Rh антитијела изузев D показују дозу (антитијело јаче реагује с хомозиготним крвним зрнцима као антигеном, него хетерезиготним зрнцима (EE има јачу реакцију у односу на Ee)).
Ако се открије анти-E, врло је вјероватно присуство анти-c (због комбинованог генетског насљеђа). Због тога је уобичајено одабрати c- и E- крв за трансфузију пацијентима који имају анти-E. Анти-c је чест узрок одложених реакција хемолитичке трансфузије.[20]
Хемолитичка болест новорођенчета уреди
Хемолитичко стање се јавља када постоји некомпатибилност између крвних група мајке и фетуса. Такође постоји потенцијална некомпатибилност ако је мајке Rh-, а отац Rh+. Када се открије било која некомпатибилност, мајке често прима инјекцију у 28. седмици трудноће и при порођају како би избјегла развој антитијела на фетус. Ови изрази не указују на то која специфична антиген—антитијело некомпатибилност је имплицирана. Поремећај у фетусу због Rh D некомпатибилности познат је као фетална еритробластоза.
- ријеч хемолиза је настала од двије грче ријечи: хема (крв) и лизис (распадање/пропадање) или распадање црвених крвних зрнаца.
- ријеч еритробластоза се односи на стварање незрелих црвених крвних зрнаца.
Када је стање узроковано Rh D некомпатибилношћу антиген—антитијело, користи се назив Rh D хемолитичка болест новорођенчета или само Rh болест. Овдје сензибилизација на Rh D антигене (обично фето-матерналном трансфузијом током трудноће) може довести до стварање мајчиних IgG анти-D антитијела која могу проћи кроз плаценту. Ово је од посебно значаја за D- жене у репродуктивној доби или раније, јер Rh D хемолитичка болест новорођенчета може утицати на било коју наредну трудноћу ако је новорођенче D+. Огромна већина Rh болести може се спријечити у савременој антенаталној њези инјекцијама IgG анти-D антитијела (Rho(D) имуно глобулин). Инциденција Rh болести математички је повезана са учесталошћу D- јединики у популацији, па је Rh болест ријетка у старосједелачким популацијама Африке и источне половине Азије, као и старосједелачким народима Океаније и Америке, али је чешћа у другим генетским групама, посебно из западне Европе, али и другим дијеловима западне Евроазије, а у мањој мјери и старосједелачки Сибирци, као и они мјешовите расе са значајним или доминантним поријеклом (нпр. велика већина Латино Америке и средње Азије).
- Симптоми и знаци код фетуса:
- Повећана јетра, слезине или срце и накупљање течности у абдомену фетуса виђено ултразвуком.
- Симптоми и знаци код новорођенчета:
- Анемија која ствара блиједило код новорођенчета.
- Жутица тј. жута боја коже, биоњаче или слузокоже новорођенчета. Ово може бити очигледно одмах након рођења или након 24—48 сати након рођења. Узроковано је билирубином (једним од крајњих продуката уништавања црвених крвних зрнаца).
- Повећање јетри и слезине новорођенчета.
- Новорођенче може имати јак едем цијелог тијела.
- Диспнеја (отежано дизање).
Подаци о популацији уреди
Према свеобухватној студији, свјетска учесталост Rh+ и Rh- крвних група приближна је постотку у односу 94:6. Иста студија је закључила да ће удио популације са Rh- крвном групом у будућности наставити даље да пада, прије свега због ниског природног прираштаја у Европи.[21] Учесталост Rh фактора крвних група и RhD- алела гена разликују се у различитим популацијама.
| Популација | Rh(D)- (%) | Rh(D)+ (%) | Rh(D)- алели (%) |
|---|---|---|---|
| Афроамериканци | ∼ 7 | 93 | ∼ 26 |
| Албанија[23] | 10,86 | 89 | слаб D 1,4 |
| Баскија[24] | 21—36 | 65 | ∼ 60 |
| Уједињено Краљевство[25] | 17 | 83 | — |
| Кина[25] | < 1 | > 99 | — |
| Етиопљани[25] | 1—21 | 99—79 | — |
| Европљани (остали) | 16 | 84 | 40 |
| Индија[25] | 0,6—8,4 | 99,4—91,6 | — |
| Индонезија[25] | < 1 | > 99 | — |
| Јапан[25] | < 1 | > 99 | — |
| Корејци[26] | < 1 | > 99 | — |
| Мадагаскар[25] | 1 | 99 | — |
| Мароканци[27] | 9,5 | 90,5 | — |
| Мароканци (Високи Атлас)[28] | ∼ 29 | 71 | — |
| Амерички старосједеоци | ∼ 1 | 99 | ∼ 10 |
| Нигерија[29] | 6 | 94 | — |
| Саудијска Арабија[30] | 8,8 | 91,2 | 29,5 |
| Субекваторијална Африка[25] | 1—3 | 99—97 | |
| Сједињене Државе[25] | 15 | 85 | — |
Насљеђивање уреди
Антиген D се насљеђује као један ген (RHD) (на кратком краку првог хромозома, p36.13—p34.3) са разним алелима. Иако веома поједностављени, могу се смислити алели који су позитивни или негативни за антиген D. Ген кодира RhD протеин на мембрани црвених крвних зрнаца. D− особе којима недостаје функционални RHD ген не производе антиген D и могу се имунизовати крвљу D+ особе.
Антиген D је доминантна особина. Ако су оба дјететова родитеља Rh-, дијете ће дефинитивно бити Rh-. У супротном, дијете може бити Rh+ или Rh-, у зависности од специфичних генотипова родитеља.[31]
Епитопи за сљедећа четири најчешћа Rh антигена — C, c, E и e — изражени су на веома сличном RhCE протеину који је генетски кодиран у RHCE гену, такође пронађено на хромозому 1. Показано је да је ген RHD настао дуплирањем гена RHCE током еволуције примата. Мишеви имају само један RH ген.[32]
RHAG ген, који је одговоран за кодирање Rh повезаним гликопротеином (RhAG), пронађен је на хромозому 6а.
Полипептиди произведени из гена RHD и RHCE формирају комплекс на мембрани црвених крвних зрнаца са Rh повезаним гликопротеином.[20]
Функција уреди
| Полипептид крвне групе Rh C/E/D | |
|---|---|
| Идентификатори | |
| Симбол | ? |
| ИнтерПро | IPR002229 |
На основу структурне хомологије предложено је да је производ гена RHD, протеин RhD, мембрански транспортни протеин несигурне специфичности (CO2 или NH3) и непознате физиолошке улоге.[33][34] Тродимензионална структура сродног RHCG протеина и биохемијска анализа RhD протеинског комплекса указују да је RhD протеин један од три подјединице преносиоца амонијака.[35][36] Три студије[37][38][39] извијестиле су о заштитном ефекту RhD+ фенотипа, посебно хетерозиготног RhD, против негативног ефекта латентне токсоплазмозе на психомоторне способности заражених субјеката. RhD- у поређењу са RhD+ испитаницима без анамнестичних титара антитијела антитоксоплазме имају краће вријеме реакције у тестовима једноставног времена реакације. И обратно, RhD- субјекти са анамнестичким титрима (тј. са латентном токсоплазмозом) показали су много дуже вријеме реакције од RhD+. Објављени подаци сугеришу да је само заштита RhD+ хетерозигота била дугорочна по природи; заштита RhD+ хомозигота смањивала се током трајања инфекције, док су се способности RhD- хомозигота смањивале одмах након инфекције. Укупна промјена у времена реакције увијек је већа код RhD- групе него код RhD+ групе.
RHD полиморфизам уреди
Поријекло RHD полиморфизма уреди
Овај одјељак вероватно садржи оригинално истраживање. |
Поријекло RHD полиморфизма дуго је било еволуциона енигма.[40][41][42] Прије појаве модерне медицине, носиоци ријеђег алела (нпр. RhD- жене у популацији RhD позитивних или RhD+ мушкарци у популацији RhD негативних) били су у неповољном положају јер су нека од њихове дјеце (RhD+ дјеца кој су родиле преимнунизоване RhD- мајке) имала већи ризик од феталне или послијепорођајне смрти или нарушавања здравља од хемолитичке болести.
Ако узмемо у обзир природну селекцију, регија RHD—RHCE је структурно предиспонирана за многе мутације забиљежена код људи, јер је пар настао дуплирањем гена и остао довољно сличан да би дошло до неједнаког преласка.[32] Поред случаја када је D избрисан, укрштање такође може произвести један ген који је мијеша ексоне и из RHD и из RHCE, чинећи већину дјелемичних D типова.[43]
Слаб D уреди
У серолошком тестирању, D+ крв се лако идентификује. Јединице које су D− често се поново тестирају како би се искључила слабија реакција. Та појава је раније означавана као Du, што је превазиђено.[44] По дефиницији, слаби D фенотип карактерише негативна реакција са анти-D реагенсом при непосредном центрифуговању (IS), негативна реакција након инкубације од 37 °C и позитивна реакција у фази антихуманог глобулина (AHG). Слаб D фенотип може се јавити на више начина. У неким случајевима овај фенотип се јавља због измијењеног површинског протеина који је чешћи код људи европског поријекла. Такође се јавља насљедни облик, као резултат ослабљеног облика гена R0. Слаб D се такође може јавити као „C in trans”, при чему је C ген пристан на хромозому супротном од D гена (као у комбинацији R0r' или „Dce/dCe”). Тестирње је тешко, јер употреба различитих анти-D реагенса, посебно старијих поликлоналних реагенса, може дати различите резултате.
Практична импликација овога је да ће људи са овим подфенотипом имати продукт означен као „D+” када дају крв. Када примају крв, понекад се уписује као „D-”, мада је ово предмет појединих расправа. Већина „слабих D” пацијената може добити „D+” крв без импликација.[43] Међутим, важно је правилно идентификовати оне који се морају сматрати D+ или D−. Ово је важно, јер већина банака крви има ограничену количину D− крви и правилна трансфузија је клинички релевантна. У том погледу, генотипизација крвних група је знатно поједноставила откривање различитих варијанти у Rh систему крвних група.
Дјелимичан D уреди
Важно је разликовати слаби D (због квантитативне разлике у антигену D) од дјелимичног D (због квалитативне разлике у антигену D). Једноставно речено, слаб D фенотип је настао због смањеног броја D антигена на црвеним крвним зрнцима. Насупрот томе, дјелимични D фенотип је посљедица промјене D-епитола. Дакле, у дјелимичном D, број D антигена се не смањује, већ се мијења структура протеина. Ове особе, ако се аломунизују на D, могу да произведу анти-D антитијело. Због тога би дјелимични D пацијенти који дају крв требали бити означени као D+, али ако примају крв, требали би бити означени као D− и примати D− јединице.[20]
У прошлости, дјелимични D се означавао као „D мозаик” или „D варијанта”. Различите дјелимичне D фенотипове дефинишу различити D епитопи на спољној површини мембране црвених крвних зрнаца. Описано је више од 30 различитих дјелимичних D фенотипова.[20]
Rh0 фенотип уреди
Rh0 особе немају Rh антигене (без Rh или RhAG) на својим црвеним крвним зрнцима. Ово ријетко стање[45] названо је „златна крв”.[46] Као посљедица одсуства Rh антигена, Rh0 црвеним крвним зрнцима такође недостају LW или Fy5 и показују слабу експресију S, s и U антигена. Црвена крвна зрнца којима недостају Rh/RhAG протеини имају структурне абнормалности (попут стоматоцитозе) и дефекте ћелијске мембране који могу резултирати хемолитичком анемијом.[20][45] Широм свијета само 43 особе имају овај фенотип. Од чега је само 9 активних донора.[46] Његова својства чине га привлачним за бројне медицинске примјене, али недостатак га чини скупим за транспорт и набавку.[47]
Референце уреди
- ^ Dean, Laura (2005). „The Rh blood group”. Blood Groups and Red Cell Antigens (на језику: енглески). National Center for Biotechnology Information (US). Приступљено 1. 6. 2021.
- ^ „Learn Serology: Introduction”. learnserology.ca (на језику: енглески). Приступљено 1. 6. 2021.
- ^ Wiener, Alexander S. (1. 12. 1949). „Genetics and nomenclature of the Rh-Hr blood types”. Antonie van Leeuwenhoek (на језику: енглески). 15 (1): 17—28. ISSN 1572-9699. doi:10.1007/BF02062626. Приступљено 1. 6. 2021.
- ^ а б Landsteiner, Karl; Wiener, Alexander S. (1. 1. 1940). „An Agglutinable Factor in Human Blood Recognized by Immune Sera for Rhesus Blood”. Proceedings of the Society for Experimental Biology and Medicine (на језику: енглески). 43 (1): 223—223. ISSN 0037-9727. doi:10.3181/00379727-43-11151.
- ^ Landsteiner, Karl; Wiener, Alexander S. (1. 10. 1941). „STUDIES ON AN AGGLUTINOGEN (Rh) IN HUMAN BLOOD REACTING WITH ANTI-RHESUS SERA AND WITH HUMAN ISOANTIBODIES”. Journal of Experimental Medicine (на језику: енглески). 74 (4): 309—320. ISSN 0022-1007. doi:10.1084/jem.74.4.309. Приступљено 13. 6. 2021.
- ^ Levine, Philip; Stetson, Rufus E. (8. 7. 1939). „AN UNUSUAL CASE OF INTRA-GROUP AGGLUTINATION”. Journal of the American Medical Association (на језику: енглески). 113 (2): 126—127. ISSN 0002-9955. doi:10.1001/jama.1939.72800270002007a.
- ^ „Rev Bernard Charles “Bernie” Schlegel (1930-1991)...”. www.findagrave.com (на језику: енглески). Приступљено 13. 6. 2021.
- ^ Levine, Philip; Burnham, Lyman; Katzin, E. M.; Vogel, Peter (1. 12. 1941). „The role of iso-immunization in the pathogenesis of erythroblastosis fetalis”. American Journal of Obstetrics & Gynecology (на језику: енглески). 42 (6): 925—937. ISSN 0002-9378. doi:10.1016/S0002-9378(41)90260-0. Приступљено 13. 6. 2021.
- ^ Avent, Neil D.; Reid, Marion E. (15. 1. 2000). „The Rh blood group system: a review”. Blood (на језику: енглески). 95 (2): 375—387. ISSN 0006-4971. doi:10.1182/blood.V95.2.375. Приступљено 13. 6. 2021.
- ^ Scott, M. L. (2004). „ES05.01 The complexities of the Rh system”. Vox Sanguinis (на језику: енглески). 87 (s1): 58—62. ISSN 1423-0410. doi:10.1111/j.1741-6892.2004.00431.x. Приступљено 13. 6. 2021.
- ^ „dbRBC – Blood Group Antigen Gene Mutation Database”. ncbi.nlm.nih.gov (на језику: енглески). Архивирано из оригинала 13. 2. 2011. г. Приступљено 1. 6. 2021.
- ^ а б „RHD Rh blood group D antigen [Homo sapiens (human)] – Gene – NCBI”. www.ncbi.nlm.nih.gov (на језику: енглески). Приступљено 1. 6. 2021.
- ^ Ottensooser, F.; Leon, N.; Sato, M.; Saldanha, P. H. (1963). „Blood groups of a population of Ashkenazi Jews in Brazil”. American Journal of Physical Anthropology (на језику: енглески). 21 (1): 41—48. ISSN 1096-8644. doi:10.1002/ajpa.1330210106.
- ^ Harrison, G. A.; Küchemann, C. F.; Moore, M. a. S.; Boyce, A. J.; Baju, T.; Mourant, Arthur Ernest; Godber, Marilyn J.; Glasgow, Bridget G.; Kopeć, Ada C.; Tills, D.; Clegg, E. J. (9. 10. 1969). „The effects of altitudinal variation in Ethiopian populations”. Philosophical Transactions of the Royal Society of London. B, Biological Sciences (на језику: енглески). 256 (805): 147—182. doi:10.1098/rstb.1969.0040. Приступљено 1. 6. 2021.
- ^ Metri, Ammaria Aouar; Sidi-Yakhlef, Adel; Biémont, Christian; Saïdi, Mohamed; Chaïf, Okacha; Ouraghi, Sid Ahmed (2012). „A genetic study of nine populations from the region of Tlemcen in Western Algeria: a comparative analysis on the Mediterranean scale”. Anthropological Science (на језику: енглески). 120 (3): 209—216. doi:10.1537/ase.120618. Приступљено 1. 6. 2021.
- ^ Skaik, Younis Abed EL-Wahhab (1. 7. 2011). „The Rh allele frequencies in Gaza city in Palestine”. Asian Journal of Transfusion Science (на језику: енглески). 5 (2): 150. ISSN 0973-6247. doi:10.4103/0973-6247.83241. Приступљено 1. 6. 2021.
- ^ Race RR, Mourant AE (1948). „The Rh Chromosome Frequencies in England”. Blood. 3 (6): 689—695. PMID 18860341. doi:10.1182/blood.V3.6.689.689 . Приступљено 2010-11-14.
- ^ Canatan, Duran; Nilgün Acar; Banu Kiliç (1999). „Rh Subgroups and Kell Antigens in Patients With Thalassemia and in Donors in Turkey” (PDF). Turkish Journal of Medical Sciences. 29: 155—7. Архивирано из оригинала (PDF) 2008-12-17. г. Приступљено 2008-10-17.
- ^ Roback, John; MD; Combs, Martha Rae; MT(ASCP)SBB; Grossman, Brenda; Hillyer, Christopher (2008). Technical Manual (на језику: енглески). Bethesda, Md.
- ^ а б в г д Mais, Daniel D. (2008). Quick compendium of clinical pathology (на језику: енглески) (2 изд.). Chicago: ASCP Press. ISBN 978-0-89189-567-1.
- ^ „Blood Type Frequencies by Country including the Rh Factor – Rhesus Negative”. www.rhesusnegative.net (на језику: енглески). Приступљено 3. 6. 2021.
- ^ Mack, Steve (21. 3. 2001). „Re: Is the RH negative blood type more prevalent in certain ethnic groups?”. MadSci Network. Архивирано из оригинала 24. 2. 2011. г.
- ^ Xhetani M, et al. (јун 2014). „Distribution of Rhesus blood group antigens and weak D alleles in the population of Albania = Blood Transfusion Journal”. Blood Transfusion. 12 (4): 565—569. PMC 4212038 . PMID 24960662. doi:10.2450/2014.0240-13.
- ^ Touinssi M, Chiaroni J, Degioanni A, De Micco P, Dutour O, Bauduer F (2004). „Distribution of rhesus blood group system in the French basques: a reappraisal using the allele-specific primers PCR method”. Human Heredity. 58 (2): 69—72. PMID 15711086. S2CID 44542508. doi:10.1159/000083027.
- ^ а б в г д ђ е ж з Golassa, Lemu; et al. (2017). „High rhesus (Rh (D)) negative frequency and ethnic-group based ABO blood group distribution in Ethiopia”. BMC Research Notes. 10 (1): 330. PMC 5530478 . PMID 28747227. doi:10.1186/s13104-017-2644-3.
- ^ Kim, Ji Yeon; Kim, Sung Yeun; Kim, Chong-Ahm; Yon, Gyu Sung; Park, Sung Sup (4. 3. 2005). „Molecular characterization of D– Korean persons: development of a diagnostic strategy”. Transfusion. 45 (3): 345—352. PMID 15752151. doi:10.1111/j.1537-2995.2005.04311.x.
- ^ EL Wafi, M; EL Housse, H; Nourichafi, N; Bouisk, K; Benajiba, M; Habti, N (2016). „Prevalence of weak D phenotype among D negative C/E+ blood donors in Morocco” (PDF). International Journal of Blood Transfusion and Immunohematology. 6 (1): 3—7. doi:10.5348/ijbti-2016-22-OA-2 . Архивирано (PDF) из оригинала 28. 8. 2016. г. Приступљено 3. 2. 2018.
- ^ Weinstock, Christof (јануар 2014). „It is worthwhile filling in the remaining blank spots for blood group antigen frequencies”. Blood Transfusion. 12 (1): 3—6. PMC 3926725 . PMID 24120599. doi:10.2450/2013.0192-13.
- ^ Enosolease ME, Bazuaye GN (јануар 2008). „Distribution of ABO and Rh-D blood groups in the Benin area of Niger-Delta: Implication for regional blood transfusion”. Asian Journal of Transfusion Science. 2 (1): 3—5. PMC 2798756 . PMID 20041069. doi:10.4103/0973-6247.39502.
- ^ Eweidah, M. H.; Rahiman, S.; Ali, M. D. H.; Al-Shamary, A. M. D. (април 2011). „Distribution of ABO and Rhesus (RHD) Blood Groups in Al-Jouf Province of the Saudi Arabia” (PDF). The Anthropologist. 13 (2): 99—102. S2CID 75537061. doi:10.1080/09720073.2011.11891182. Архивирано (PDF) из оригинала 2. 1. 2013. г. Приступљено 3. 2. 2018.
- ^ „ABO inheritance patterns”. transfusion.com.au (на језику: енглески). Приступљено 3. 6. 2021.
- ^ а б Wagner, Franz F.; Flegel, Willy A. (15. 3. 2002). „RHCE represents the ancestral RHposition, while RHD is the duplicated gene”. Blood. 99 (6): 2272—2274. ISSN 0006-4971. doi:10.1182/blood-2001-12-0153. Приступљено 3. 6. 2021.
- ^ Kustu, S.; Inwood, W. (1. 3. 2006). „Biological gas channels for NH3 and CO2: evidence that Rh (Rhesus) proteins are CO2 channels”. Transfusion Clinique et Biologique (на језику: енглески). 13 (1-2): 103—110. ISSN 1246-7820. doi:10.1016/j.tracli.2006.03.001. Приступљено 3. 6. 2021.
- ^ Biver, S.; Scohy, S.; Szpirer, J.; Szpirer, C.; André, B.; Marini, A.-M. (1. 3. 2006). „Physiological role of the putative ammonium transporter RhCG in the mouse”. Transfusion Clinique et Biologique (на језику: енглески). 13 (1-2): 167—168. ISSN 1246-7820. doi:10.1016/j.tracli.2006.03.003. Приступљено 3. 6. 2021.
- ^ Gruswitz, Franz; Chaudhary, Sarika; Ho, Joseph D.; Schlessinger, Avner; Pezeshki, Bobak; Ho, Chi-Min; Sali, Andrej; Westhoff, Connie M.; Stroud, Robert M. (25. 5. 2010). „Function of human Rh based on structure of RhCG at 2.1 Å”. Proceedings of the National Academy of Sciences (на језику: енглески). 107 (21): 9638—9643. ISSN 0027-8424. doi:10.1073/pnas.1003587107. Архивирано из оригинала 10. 06. 2021. г. Приступљено 3. 6. 2021.
- ^ Westhoff, Connie M. (1. 1. 2007). „The Structure and Function of the Rh Antigen Complex”. Seminars in Hematology (на језику: енглески). 44 (1): 42—50. ISSN 0037-1963. doi:10.1053/j.seminhematol.2006.09.010. Приступљено 3. 6. 2021.
- ^ Novotná, M.; Havlíček, J.; Smith, A. P.; Kolbeková, P.; Skallová, A.; Klose, J.; Gašová, Z.; Písačka, M.; Sechovská, M.; Flegr, J. (2008). „Toxoplasma and reaction time: role of toxoplasmosis in the origin, preservation and geographical distribution of Rh blood group polymorphism”. Parasitology (на језику: енглески). 135 (11): 1253—1261. ISSN 1469-8161. doi:10.1017/S003118200800485X. Приступљено 10. 6. 2021.
- ^ Flegr, Jaroslav; Novotná, Martina; Lindová, Jitka; Havlícek, Jan (август 2008). „Neurophysiological effect of the Rh factor. Protective role of the RhD molecule against Toxoplasma-induced impairment of reaction times in women”. Neuro Endocrinology Letters. 29 (4): 475—481. ISSN 0172-780X. Приступљено 10. 6. 2021.
- ^ Flegr, Jaroslav; Klose, Jiří; Novotná, Martina; Berenreitterová, Miroslava; Havlíček, Jan (26. 5. 2009). „Increased incidence of traffic accidents in Toxoplasma-infected military drivers and protective effect RhD molecule revealed by a large-scale prospective cohort study”. BMC Infectious Diseases (на језику: енглески). 9 (1): 72. ISSN 1471-2334. doi:10.1186/1471-2334-9-72. Приступљено 10. 6. 2021.
- ^ Haldane, J. B. S. (1941). „Selection Against Heterozygosis in Man”. Annals of Eugenics (на језику: енглески). 11 (1): 333—340. ISSN 2050-1439. doi:10.1111/j.1469-1809.1941.tb02297.x. Приступљено 10. 6. 2021.
- ^ Fisher, R. A.; Race, R. R.; Taylor, G. L. (јануар 1944). „Mutation and the Rhesus Reaction”. Nature (на језику: енглески). 153 (3873): 106—106. ISSN 1476-4687. doi:10.1038/153106b0. Приступљено 10. 6. 2021.
- ^ Li, C. C. (1. 7. 1953). „Is Rh Facing a Crossroad? A Critique of the Compensation Effect”. The American Naturalist (на језику: енглески). 87 (835): 257—261. ISSN 0003-0147. doi:10.1086/281782. Приступљено 10. 6. 2021.
- ^ а б Brecher 2005, стр. 323.
- ^ Brecher 2005, стр. 322.
- ^ а б Cartron, Jean-Pierre (1. 12. 1999). „RH blood group system and molecular basis of Rh-deficiency”. Best Practice & Research Clinical Haematology (на језику: енглески). 12 (4): 655—689. ISSN 1521-6926. doi:10.1053/beha.1999.0047. Приступљено 10. 6. 2021.
- ^ а б „Rhnull, the Rarest Blood Type on Earth, Has Been Called the "Golden Blood"”. Curiosity.com (на језику: енглески). Архивирано из оригинала 5. 12. 2019. г. Приступљено 10. 6. 2021.
- ^ Bailey, Penny (20. 10. 2014). „The man with the golden blood”. Mosaic Science (на језику: енглески). Приступљено 10. 6. 2021.
Литература уреди
- Brecher, Mark E. (2005). Technical manual (на језику: енглески) (15 изд.). Bethesda, Md.: American Association of Blood Banks. ISBN 978-1-56395-196-1.