Саудерн блот
Саудерн блот (енг. Southern blot) је метода која се користи у молекуларној биологији за откривање специфичне секвенце ДНК у узорцима ДНК. Саудерн блот комбинује пренос фрагмената ДНК који су раздвојени гел-електрофорезом на филтер мембрану и накнадно детектовање фрагмената хибридизацијом са обележеним пробама.

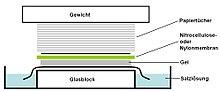


Метода је добила име по британском биологу Едвину Саудерну (енг. Edwin Southern) који ју је први пут објавио 1975. [1] Остале методе блотирања (Вестерн блот [2](Western blot), Нордерн блот (Northern blot), Истерн блот (Eastern blot) или Саутвестерн блот (Southwestern blot)) користе сличне принципе, али користећи РНК или протеин уместо ДНК и именоване су по аналогији са Саудерн блотом. [3]
Метод уреди
- Ензими рестрикционе ендонуклезе користе се за сечење молекула ДНК велике молекулске масе на мање фрагменте.
- Електрофореза дволанчаних ДНК фрагмената на агарозном гелу како би се фрагменти раздвојили по величини.
- Ако су неки фрагменти ДНК већи од 15 кб, тада пре анализе агарозни гел може бити третиран киселином, као што је разблажена HCl. Ово доводи до делимичне хидролизе, тј. фрагментације молекула ДНК узроковану депуринацијом и на тај начин омогућава ефикаснији пренос више мањих фрагмената молекула ДНК са гела на мембрану.
- Агарозни гел се ставља у алкални раствор (који обично садржи натријум хидроксид) да би се денатурисала дволанчана ДНК, тј. добило два једноланчана ДНК фрагмента из једног дволанчаног. Денатурација се постиже тако што алкални раствор побољшава везивање негативно наелектрисаних остатака тимина ДНК за позитивно наелектрисане амино групе филтер мембране. Алкални раствор такође уништава сваку заосталу РНК која може бити присутна у узорку са ДНК. Ово је такозвана метода алкалног преноса. Денатурисана ДНК је потребна за каснију хибридизацију са пробом (корак 7.).
- Уз гел се поставља слој нитроцелулозне (или алтернативно најлонске) мембране . Притисак се наноси равномерно на гел (било усисавањем, било постављањем снопа папирних салвета и тега на мембрану и гел), како би се осигурао добар и равномерни контакт гела и мембране. Ако се трансфер ДНК са гела на мембрану врши усисавањем, користи се 20X SSC пуфер да се осигура заптивање и спречи сушење гела. Прелазак пуфера капиларним деловањем из региона високог водног потенцијала (агарозни гел) у подручје ниског водног потенцијала (обично филтер папир) се затим користи за премештање ДНК из гела на мембрану. Јонске везе везују пренесену ДНК за мембрану услед негативног наелектрисања ДНК и позитивног наелектрисања мембране.
- Мембрана се затим загрева у вакууму или обичној пећи на 80 °C током 2 сата (стандардни услови; нитроцелулозна или најлонска мембрана) или изложени ултраљубичастом зрачењу (најлонска мембрана) за трајно везивање пренесене ДНК на мембрану.
- Мембрана се затим излаже проби за хибридизацију- јединствен фрагмент ДНК са специфичном секвенцом комплементарном циљној секвенци (секвенца чија се присутност у узорку ДНК треба потврдити). ДНК проба је обележена тако да се може детектовати, обично укључивањем радиоактивности или обележавањем молекула флуоресцентним или хромогеним бојама. У неким случајевима проба за хибридизацију може да се направи од РНК, а не из ДНК. Да би се осигурала специфичност везивања пробе за ДНК узорка, најчешће методе хибридизације користе ДНК сперме лососа или харинге за блокирање површине мембране и циљне ДНК, дејонизовани формамид и детерџенте као што је СДС да би се смањило неспецифично везивање проба.
- После хибридизације, вишак пробе се испере са мембране (обично се користи SSC пуфер ). Образац хибридизације се на радиографском филму визуелно приказује ауторадиографијом у случају радиоактивне или флуоресцентне пробе или развијањем боје на мембрани ако се користи хромогена метода детекције.
Резултат уреди
Хибридизација пробе за одређени фрагмент ДНК на филтер мембрани указује да овај фрагмент садржи ДНК секвенцу која је комплементарна проби. Корак преноса ДНК са гела за електрофорезу на мембрану омогућава лако везивање обележене хибридизационе пробе за фрагменте ДНК узорка који испитујемо. Такође омогућава фиксирање хибрида циљна ДНК-проба, која је потребна за анализу ауторадиографијом или другим методама детекције.
Саудерн блот извршен рестрикционом дигестијом геномске ДНК може се користити за одређивање броја секвенци (нпр.броја копија гена) у геному. Проба која је хибридизовала са само једним ДНК сегментом ће произвести једну траку на Саудерн блоту, док ће се више трака опажати када проба хибридизује са неколико врло сличних секвенци (нпр.оних које могу бити резултат дуплирања секвенци).
Модификација услова хибридизације (на пример, повећање температуре хибридизације или смањење концентрације соли) може се користити за повећање специфичности везивања пробе за ДНК узорка.
Примене уреди
Саудерн блот се може користити за одређивање непознате секвенце гена чији је протеински продукт познат. На основу протеинског продукта поштујући правила генетичког кода дизајнирају се се пробе тако да су комплементарне претпостављеној секвенци датог гена. Пробе су хемијски синтетисане, радиоактивно обележене и користе се за претраживање ДНК библиотеке или друге колекције клонираних фрагмената ДНК. Секвенце ДНК које хибридизују са пробом се користе да би се одредила секвенца циљног гена.
Саудерн блот се такође може користити за идентификацију метилованих места у одређеним генима. Посебно су корисне рестрикционе нуклеазе MspI и HpaII јер обе препознају и секу ДНК на истом месту. Међутим, HpaII захтева да цитозин унутар тог места буде метилован, док MspI сече само неметиловану ДНК на истом том месту. Стога ће свако метиловано место унутар секвенце анализиране одређеном пробом сећи HpaII, а не MspI. На основу обрасца сечења ДНК који се визуализује захваљујући Саудерн блот методи закључује се да ли је одређени део секвенце узорка ДНК метилован или није. [4]
Види још уреди
Референце уреди
- ^ Southern, Edwin Mellor (5. 11. 1975). „Detection of specific sequences among DNA fragments separated by gel electrophoresis”. Journal of Molecular Biology. 98 (3): 503—517. ISSN 0022-2836. PMID 1195397. doi:10.1016/S0022-2836(75)80083-0.
- ^ Towbin; Staehelin, T; Gordon, J; et al. (1979). „Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications”. PNAS. 76 (9): 4350—4. PMC 411572 . PMID 388439. doi:10.1073/pnas.76.9.4350.
- ^ Burnette, W. Neal (април 1981). „Western Blotting: Electrophoretic Transfer of Proteins from Sodium Dodecyl Sulfate-Polyacrylamide Gels to Unmodified Nitrocellulose and Radiographic Detection with Antibody and Radioiodinated Protein A”. Analytical Biochemistry. 112 (2): 195—203. ISSN 0003-2697. PMID 6266278. doi:10.1016/0003-2697(81)90281-5.
- ^ Biochemistry 3rd Edition, Matthews, Van Holde et al, Addison Wesley Publishing, pg 977