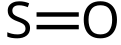Сумпор-моноксид
Сумпор-моноксид (сумпор(II)-оксид) је неорганско хемијско једињење хемијске формуле SO.
| |||

| |||
| Називи | |||
|---|---|---|---|
| IUPAC назив
Сумпор моноксид
| |||
| Системски IUPAC назив
Оксидосумпор[1] | |||
| Идентификација | |||
3Д модел (Jmol)
|
|||
| Бајлштајн | 7577656 | ||
| ChEBI | |||
| ChemSpider | |||
| Гмелин Референца | 666 | ||
| MeSH | sulfur+monoxide | ||
| |||
| |||
| Својства | |||
| SO | |||
| Моларна маса | 48,064 g mol-1 | ||
| Агрегатно стање | Безбојни гас | ||
| Реактиван је | |||
| log P | 0.155 | ||
| Термохемија | |||
Стандардна моларна
ентропија (S |
221.94 J K-1 mol-1 | ||
Стандардна енталпија
стварања (ΔfH |
5.01 kJ mol-1 | ||
| Опасности | |||
| NFPA 704 | |||
| Сродна једињења | |||
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25°C [77°F], 100 kPa). | |||
| Референце инфокутије | |||
Хемијска формула уреди
-
Структурна формула сумпор-моноксида
-
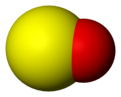
Модел молекула сумпор-моноксида
-
Структурна формула дисулфид-диоксида
-
Модел молекула дисулфид-диоксида
Историјат и добијање уреди
Шенк је 1935. добио сумпор-моноксид помешан са сумпор-диоксидом сагоревањем сумпора под одређеним условима. Тврдио је и да га је добио 1932. дејством електричног пражњења на смешу сумпор-диоксида и сумпора на ниским притисцима.[4]
Физичко-хемијске особине уреди
Ово је безбојан гас који се врло лако распада, посебно у присуству воде и органских материјала. Једини се са кисеоником уз пропуштање варнице и тада даје сумпор-диоксид, а са металима гради сулфиде.[4]
Извори уреди
- ^ „sulfur monoxide (CHEBI:45822)”. Chemical Entities of Biological Interest. UK: European Bioinformatics Institute. Архивирано из оригинала 07. 07. 2013. г. Приступљено 22. 12. 2011.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б Parkes, G.D. & Phil, D. 1973. Мелорова модерна неорганска хемија. Научна књига. Београд.