Боран
У хемији, боран је хемијско једињење бора и водоника. Борани обухватају велику групу једињења са општом формулом BxHy.[3][4] Та једињења се не јављају у природи. Многи борани се лако оксидују у контакту са ваздухом, неки бурно. Основни члан BH3 се зове боран. Он је познат само у гасовитом стању. Он се димеризује да формира диборан, B2H6. Већи борани се састоје од кластера бора који су полиедарски, неки од њих постоје као изомери. На пример, изомери B20H26 су базирани на фузији два десетоатомна клустера.
| |||
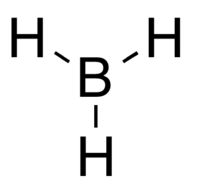
 Модел борана, BH3, који је високо реактиван.
| |||
| |||
 BH3 формира димери диборан, B2H6.
| |||
| Идентификација | |||
|---|---|---|---|
3Д модел (Jmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| |||
| Својства | |||
| BH3 | |||
| Моларна маса | 13,835 | ||
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25 °C [77 °F], 100 kPa). | |||
| Референце инфокутије | |||
Најважнији борани су диборан B2H6, пентаборан B5H9, и декаборан B10H14. Развој хемије бор хидрида је омогућио развој нових експерименталних техника и теоретских концепта. Бор хидриди су студирани као потенцијална горива за ракета и за аутомобилску примену.
Током задњих неколико декада, досег хемије бор хидрида је порастао да обухвати атоме осом бора, као што је угљеник у карборанима и метали у металборанима, где је један или више атома бора замењен металним атомима.
Особине уреди
Борани које је користио и правио Алфред Шток имали су опсту формулу БнХн+4 и БнХн+6, али данас су позната и комплекснија једињења, како неутрална тако и негативна (ањонска). Хидриди бора бројнији су од хидрида свих осталих елемената сем угљеника. Најједноставнији боран који се може изоловати је Б2Х6, диборан(6). Он се највише користи и истражује. Комерцијално је доступан, и дуг низ година борани и њихови деривати синтетисани су управо од њега, директно или индиректно. Слободни молекули БХ3 (и Б3Х7) су веома нестабилни, али могу бити изоловани као стабилни продукти адиције са Луисовим базама, на пример БХ3·Н(ЦХ3)3. Борани могу бити у сва три агрегатна стања, и њихове тачке топљења и кључања расту са релативном атомском масом и комплексношћу.
| тачка топљења (°Ц) | тачка кључања (°Ц) | |
|---|---|---|
| Б2Х6, диборан(6) | -165 | -93 |
| Б4Х10, тетраборан(10) | -122 | 16 |
| Б5Х9, пентаборан(9) | -47 | 60 |
| Б5Х11, пентаборан(11) | -123 | 65 |
| Б6Х10, хексаборан(10) | -62 | 108 |
| Б10Х14, декаборан(14) | 100 | 213 |
| Особина | Вредност |
|---|---|
| Партициони коефицијент[5] (ALogP) | 3,2 |
| Растворљивост[6] (logS, log(mol/L)) | 1,4 |
| Поларна површина[7] (PSA, Å2) | 0,0 |
Историја уреди
Хидрате борана је први пут систематично синтетисао и окарактерисао између 1912. и 1937. године Алфред Шток. Хидриди угљеника (налази се до бора у ПСЕ) су алкани (засићени угљоводоници), па је Шток аналогно назвао хидриде бора боранима. Посто лакши борани бурно реагују, токсични су и осетљиви на ваздух и влажност, Шток је развио методе и апаратуру за проучавање борана која је користила вакуум. Америцки рад на боранима почели су 1931. године Херман I. Слесингер и Антон Б. Бург. Борани су били само у академским интересима све до Другог светског рата, када је америчка влада подржала истраживање да се надју експлозивна једињења уранијума због издвајања изотопа, и 1950-их година када је америчка влада подржала програме да се пронадју високо-енергетска горива за ракете и млазњаке (борани и њихови деривати имају много веће топлоте сагоревања од угљоводоника). Вилијам Липскомб Јуниор је 1976. године добио Нобелову награду из хемије за "његова истраживања структуре борана, осветљујуци проблеме хемијских веза". Херберт Браун, његов ученик, је 1979. године делио Нобелову награду за реакцију хидроборовања (1956), веома једноставну реакцију адиције БХ3 незасићеним органским једињењима (нпр. алкени и алкини) у етарским растварацима на собној температури да би настали органоборани квантитативно (висок принос, скоро потпуна реакција). Реакција хидроборације је отворила нове перспективе у области неких органских синтеза.[8].
Референце уреди
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th изд.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
- ^ Ghose, A.K.; Viswanadhan V.N. & Wendoloski, J.J. (1998). „Prediction of Hydrophobic (Lipophilic) Properties of Small Organic Molecules Using Fragment Methods: An Analysis of AlogP and CLogP Methods”. J. Phys. Chem. A. 102: 3762—3772. doi:10.1021/jp980230o.
- ^ Tetko IV, Tanchuk VY, Kasheva TN, Villa AE (2001). „Estimation of Aqueous Solubility of Chemical Compounds Using E-State Indices”. Chem Inf. Comput. Sci. 41: 1488—1493. PMID 11749573. doi:10.1021/ci000392t.
- ^ Ertl P.; Rohde B.; Selzer P. (2000). „Fast calculation of molecular polar surface area as a sum of fragment based contributions and its application to the prediction of drug transport properties”. J. Med. Chem. 43: 3714—3717. PMID 11020286. doi:10.1021/jm000942e.
- ^ Енциклопедија Британика, http://www.britannica.com/EBchecked/topic/73805/borane
Литература уреди
- Фоx, Марк А.; Wаде, Кен (2003). „Еволвинг паттернс ин борон цлустер цхемистрy”. Пуре Аппл. Цхем. 75 (9): 1315—1323. дои:10.1351/пац200375091315.
- Греенwоод, Норман Н.; Еарнсхаw, Алан (1997). Цхемистрy оф тхе Елементс (II изд.). Оxфорд: Буттерwортх-Хеинеманн. ИСБН 0080379419.
- Цоттон Ф. Алберт; Wилкинсон Геоффреy; Мурилло Царлос А; Боцхманн, Манфред (1999). Адванцед Инорганиц Цхемистрy (6тх изд.). Неw Yорк: Wилеy-Интерсциенце. ИСБН 0-471-19957-5.

