Натријум карбонат
Натријум карбонат (Na2CO3), често погрешно назван сода, јесте со натријума и угљене киселине (H2CO3). Као додатак прехрамбеним производима носи ознаку Е500. Све форме су беле, у води растворне соли. Све форме имају јако алкални укус и формирају умерено алкалне растворе у води. Историјски ова со је екстрахована из пепела биљки које расту на натријумом батом земљишту. Како је пепео ових биљака богатих натријумом био је приметно различит од пепела из дрвета (некада кориштеног за производњу поташе), натријум карбонат је остао познат као „содни пепео”.[14] Он се производи у великим количинама из натријум хлорида и кречњака путем Солвејовог процеса.

| |
| |
| |
| Називи | |
|---|---|
| IUPAC назив
Natrijum karbonat
| |
| Други називи
Сода пепео
Сода за прање Сода цристали | |
| Идентификација | |
3Д модел (Jmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.007.127 |
| EC број | 207-838-8 |
| Е-бројеви | Е500(и) (регулатор киселости, ...) |
| RTECS | ВЗ4050000 |
| УНИИ | |
| |
| Својства | |
| Na2CO3 | |
| Моларна маса | 105,9888 g/mol (anhidrat) 286,1416 g/mol (dekahidrat) |
| Агрегатно стање | Бела чврста материја, хигроскопна |
| Мирис | Безмирисан |
| Густина | |
| Тачка топљења | 851 °C (1.564 °F; 1.124 K) (Anhidratni) 100 °C (212 °F; 373 K) razlaže se (monohidrat) 33,5 °C (92,3 °F; 306,6 K) razlaže se (heptahidrat) 34 °C (93 °F; 307 K) (dekahidrat)[4][8] |
Анхидратни, g/100 mL:
| |
| Растворљивост | Растворан у аq. алкалијама,[5] глицеролу Донекле растворан у аq. алкохолу Нерастворан у ЦС2, ацетону, алкил ацетату, алкохолу, бензонитрилу, течном амонијаку[6] |
| Растворљивост у глицерин | 98,3 g/100 g (155 °C)[6] |
| Растворљивост у етандиол | 3,46 g/100 g (20 °C)[7] |
| Растворљивост у диметилформамид | 0,5 g/kg[7] |
| Базност (пКб) | 3,67 |
| −4,1·10−5 cm³/mol[4] | |
| Индекс рефракције (nD) | 1,485 (анхидратни) 1,420 (монохидрат)[8] 1.405 (декахидрат) |
| Вискозност | 3,4 cP (887 °C)[7] |
| Структура | |
| Кристална решетка/структура | моноклинична (γ-форма, β-форма, δ-форма, анхидрат)[9] Орторомбна (монохидрат, хептахидрат)[3][10] |
| Кристалографска група | C2/m, br. 12 (γ-forma, anhidrat, 170 K) C2/m, br. 12 (β-forma, anhidrat, 628 K) P21/n, br. 14 (δ-forma, anhidrat, 110 K)[9] Pca21, br. 29 (monohidrat)[3] Pbca, br. 61 (heptahidrat)[10] |
| 2/m (γ-форма, β-форма, δ-форма, анхидрат)[9] мм² (монохидрат)[3] 2/m 2/m 2/m (хептахидрат)[10] | |
a = 8,920(7) Å, b = 5,245(5) Å, c = 6,050(5) Å (γ-forma, anhidrat, 295 K)[9] α = 90°, β = 101,35(8)°, γ = 90°
| |
| Геометрија молекула | Октаедрална (Na+, анхидрат) |
| Термохемија | |
| Специфични топлотни капацитет, C | 112,3 J/mol·K[4] |
| Стандардна моларна ентропија S |
135 J/mol·K[4] |
Стд енталпија
формирања (ΔfH⦵298) |
−1130,7 kJ/mol[4][7] |
Гибсова слободна енергија (ΔфГ˚)
|
−1044,4 kJ/mol[4] |
| Opasnosti | |
| Opasnost u toku rada | Iritant |
| Bezbednost prilikom rukovanja | MSDS |
| GHS grafikoni |  [11] [11]
|
| GHS signalna reč | Upozorenje |
| H319[11] | |
| P305+351+338[11] | |
| NFPA 704 | |
| Letalna doza ili koncentracija (LD, LC): | |
LD50 (LD50)
|
4090 mg/kg (пацов, орално)[12] |
| Сродна једињења | |
Други ањони
|
Натријум бикарбонат |
Други катјони
|
Литијум карбонат Калијум карбонат Рубидијум карбонат Цезијум карбонат |
Сродна једињења
|
Амонијум карбонат Натрон Натријум перкарбонат |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25 °C [77 °F], 100 kPa). | |
| Референце инфокутије | |
Модификације уреди
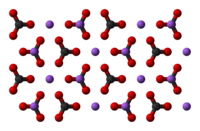
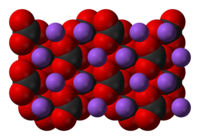
Натријум карбонат је полиморфна супстанца, која кристализира у различитим кристалним системима, у зависности од притиска и температуре. Може бити безводна или садржавати кристалну воду (хидрат).
- Безводни натријум карбонат: Познат и као минерал натрит или као калцинисана сода. То је бели прах који се топи на 853 °Ц и има густоћу од 2,51 г/цм³. Ствара се на температурама вишим од 107 °Ц.
- Монохидрат, Na2CO3•H2O: Познат и као минерал термонатрит, ствара се на температурама вишим од 35,4 °Ц из хептахидрата.
- Дихидрат, Na2Ca(CO3)2•2H2O: познат и као минерал пирсонит
- Пентахидрат, Na2Ca(CO3)2•5H2O: минерал Гаилусит или натрокалцит.
- Хептахидрат, Na2Ca(CO3)2•7H2O: Ствара се на температурама изнад 32,5 °Ц из декахидрата.
- Декахидрат, Na2Ca(CO3)2•10H2O: познат и као минерал сода или кристална сода, кристализира се на температурама испод 32,5 °Ц из засићеног раствора натријум карбоната.
Декахидрат се формира из водених раствора кристализацијом у температурном опсегу -2,1 до +32,0 °Ц, хептахидрат у уском опсегу 32,0 до 35,4 °Ц, а изнад те температуре монохидратне форме.[15] На сувом ваyдуху декахидрат и хептахидрат губе боду и дају монохидрат. Други хидрати су описани у литератури, е.г. са 2,5 јединица воде по једници натријум карбоната (пентахемихидрат).[16]
Особине уреди
Као со слабе угљене киселине реагује са јаким киселинама које из њега истискују угљен-диоксид. У води се раствара ослобађајући топлоту те услед хидролизе даје базни раствор.
Налазишта уреди
Већа налазишта натријум карбоната се налазе у Египту (језеро Натрон), источној Африци (многа исушена језера и водотоци), Калифорнији, Мексику и јужној Сахари.
Употреба уреди
Натријум карбонат се користи још од античког доба. У старом Египту се користио за мумифицирање, као и за производњу керамике, стакла те као средство за чишћење. Данас се користи у разне индустријске сврхе, те се сматра једним од важних хемијских производа. У свету се годишње произведе око 39 милиона тона соде (1997), а највећи део се употреби у индустрији стакла, производњи средстава за чишћење и избељивање, индустрији папира и другим.[17]
Производња стакла уреди
Натријум карбонат служи као средство за одвајање силике, снижавање тачке топљења смеше до вредности оствариве без примене специјалних материјала. Ово „содно стакло” је у извесној мери растворно у води, те се додаје калцијум карбонат у истопљену смешу да би се формирано стакло учинило нерастворним. Боце и прозорско стакло (содно-кречњачко стакло) је направљено топљењем таквих смеша натријум карбоната, калцијум карбоната, и силицијумског песка (силицијум диоксида (SiO2)). Кад се ови материјали загреју, карбонати ослобађају угљен диоксид. На тај начин, натријум карбонат је извор натријум оксида. Содно кречњачко стакло је вековима било најчешћа форма стакла.
Омекшавање воде уреди
Натријум карбонат се користио за омекшавање воде путем уклањања Mg2+ и Ca2+. Ови јони формирају нерастворне чврсте преципитате након третмана са карбонатним јонима:
- Ca2+ + CO32- → CaCO3
Натријум карбонат је јефтин и у води растворан извор карбонатних јона.
Прехрамбени адитиви и кување уреди
Натријум карбонат је прехрамбени адитив (Е500) који се користи као регулатор киселости, агенс за спречавање лепљења, агенс за подизање теста, и стабилизатор. Он је једна од компоненти кансуи (かん水), раствора алкалних соли које се користе за давање рамен кнедлама њиховог карактеристичног укуса и текстуре. Он се користи у продукцији снуса за стабилизовање pH вредности финалног производа. Натријум карбонат се користи у продукцији шербет праха. Осећај хлађења и пењења је резултат ендотермне реакције између натријум карбоната и слабе киселине, обично лимунске киселине, чиме се ослобађа угљен диоксидни гас, до чега долази кад се шербет овлажи пљувачком. У Кини се он користи у замени за лужину воду у кори традиционалних кантонских месечевих колача, и у многим другим кинеским куваним пецивима и резанцима. У кувању, натријум карбонат се понекад користи уместо натријум хидроксида за залужавање, посебно у немачким перецама и лужном пециву. Ова јела се третирају раствором алкалне супстанце да би се променио pH површине хране и побољшала појава браон боје.
Слаба база уреди
Натријум карбонат се такође користи као релативно јака база у разним пољима. Као уобичајена алкалија, пожељан је у многим хемијским процесима, јер је јефтинији од NaOH и далеко безбеднији за руковање. Због благости нарочито се препоручује његова употреба у применама у домаћинству.
На пример, он се може користити као pH регулатор за одржавање стабилних алкалних услова неопходних за дејство већине фотографских агенаса за развијање филма. Он је уобичајени адитив воде у пливачким базенима и акваријумима ради одржавања жељене pH вредности и карбонатне тврдоће (KH). У бојењу са бојама које реагују са влакнима, натријум карбонат (обично под именом као што је фиксирајући содни пепео или активирајући содни пепео) се користи за осигуравање одговарајућег хемијског везивања боје са целулозним (биљним) влакнима, типично пре бојења (за везивање боје), помешан са бојом (за сликарске боје), или након бојења (за бојење потапањем).
Натријум бикарбонат (NaHCO3) или пекарска сода, који је исто тако компонента апарата за гашење пожара, често се формира из натријум карбоната. Мада је сам NaHCO3 интермедијерни продукт Солвејевог поступка, загревање је неопходно да би се уклонио амонијак који га контаминира. При томе се разлаже део NaHCO3, те је економичније да се реагује завршни Na2CO3 са CO2:
- Na2CO3 + CO2 + H2O → 2NaHCO3
У сродној реакцији, натријум карбонат се користи за прављење натријум бисулфита (NaHSO3), који се користи за „сулфитни” метод одвајања лигнина од целулозе. Он се користи за уклањање сумпор диоксида из димњачких гасова у електранама:
- Na2CO3 + SO2 + H2O → NaHCO3 + NaHSO3
Овај вид примене постаје све заступљенији, посебно тамо где електране морају да задовоље строже критеријуме емисионе контроле.
Натријум карбонат се користи у индустрију памука за неутралисање сумпорне киселине неопходне за киселинско одвајање памучних семенки.
Разно уреди
Натријум карбонат је кориштен у индустрији цигле као агенс за влажење ради умањења количине воде потребне за екструдирање глине. У ливењу, он је називан „везујућим агенсом” и кориштен је да се омогући влажном алгинату да прионе на гелирани алгинат. Натријум карбонат се користи у пастама за зубе, где делује као агенс за формирање пене и као абразив, и за привремено повећање pH вредности уста.
Галерија уреди
Референце уреди
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Еван Е. Болтон; Yанли Wанг; Паул А. Тхиессен; Степхен Х. Брyант (2008). „Цхаптер 12 ПубЦхем: Интегратед Платформ оф Смалл Молецулес анд Биологицал Ацтивитиес”. Аннуал Репортс ин Цомпутатионал Цхемистрy. 4: 217—241. дои:10.1016/С1574-1400(08)00012-1.
- ^ а б в г Харпер, Ј.П (1936). Антипов, Евгенy; Бисмаyер, Улрицх; Хуппертз, Хуберт; Петрíцек, Вáцлав; Пöттген, Раинер; Сцхмахл, Wолфганг; Тиекинк, Е.Р.Т.; Зоу, Xиаодонг, ур. „Црyстал Струцтуре оф Содиум Царбонате Монохyдрате, На2ЦО3. Х2О”. Зеитсцхрифт фüр Кристаллограпхие - Црyсталлине Материалс. 95 (1): 266—273. ИССН 2196-7105. дои:10.1524/зкри.1936.95.1.266. Приступљено 25. 7. 2014.
- ^ а б в г д ђ е Лиде, Давид Р., ур. (2009). ЦРЦ Хандбоок оф Цхемистрy анд Пхyсицс (90тх изд.). Боца Ратон, Флорида: ЦРЦ Пресс. ИСБН 978-1-4200-9084-0.
- ^ а б Сеиделл, Атхертон; Линке, Wиллиам Ф. (1919). Солубилитиес оф Инорганиц анд Органиц Цомпоундс (2нд изд.). Неw Yорк: D. Ван Ностранд Цомпанy. стр. 633.
- ^ а б Цомеy, Артхур Мессингер; Хахн, Доротхy А. (фебруар 1921). А Дицтионарy оф Цхемицал Солубилитиес: Инорганиц (2нд изд.). Неw Yорк: Тхе МацМиллан Цомпанy. стр. 208–209.
- ^ а б в г Анатолиевицх, Кипер Руслан. „содиум царбонате”. цхемистер.ру. Приступљено 25. 7. 2014.
- ^ а б Прадyот, Патнаик (2003). Хандбоок оф Инорганиц Цхемицалс. Тхе МцГраw-Хилл Цомпаниес, Инц. стр. 861. ИСБН 978-0-07-049439-8.
- ^ а б в г Дусек, Мицхал; Цхапуис, Герваис; Меyер, Матхиас; Петрицек, Вацлав (2003). „Содиум царбонате ревиситед” (ПДФ). Ацта Црyсталлограпхица Сецтион Б. 59 (3): 337—352. ИССН 0108-7681. дои:10.1107/С0108768103009017. Приступљено 25. 7. 2014.
- ^ а б в Бетзел, C.; Саенгер, W.; Лоеwус, D. (1982). „Содиум Царбонате Хептахyдрате”. Ацта Црyсталлограпхица Сецтион Б. 38 (11): 2802—2804. дои:10.1107/С0567740882009996.
- ^ а б в Сигма-Алдрицх Цо. Ретриевед он 6. 5. 2014.
- ^ Цхамберс, Мицхаел. „ЦхемИДплус - 497-19-8 - ЦДБYЛПФСWЗWЦQЕ-УХФФФАОYСА-L - Содиум царбонате [НФ] - Симилар струцтурес сеарцх, сyнонyмс, формулас, ресоурце линкс, анд отхер цхемицал информатион”.
- ^ „Материал Сафетy Дата Схеет – Содиум Царбонате, Анхyдроус” (ПДФ). цонсерватионсуппортсyстемс.цом. ЦонсерватионСуппортСyстемс. Приступљено 25. 7. 2014.
- ^ „минералс.усгс.гов/минералс” (ПДФ).
- ^ Т.W.Рицхардс анд А.Х. Фиске (1914). „Он тхе транситион температурес оф тхе транситион температурес оф тхе хyдратес оф содиум царбонате ас фиx поинтс ин тхермометрy”. Јоурнал оф тхе Америцан Цхемицал Социетy. 36 (3): 485—490. дои:10.1021/ја02180а003.
- ^ Пабст, А. „Он тхе хyдратес оф содиум царбонате” (ПДФ).
- ^ Тхиеме, Цхристиан (2000). „Содиум Царбонатес”. Уллманн'с Енцyцлопедиа оф Индустриал Цхемистрy. Wеинхеим: Wилеy-ВЦХ. ИСБН 978-3527306732. дои:10.1002/14356007.а24_299.
Литература уреди
- Цомеy, Артхур Мессингер; Хахн, Доротхy А. (фебруар 1921). А Дицтионарy оф Цхемицал Солубилитиес: Инорганиц (2нд изд.). Неw Yорк: Тхе МацМиллан Цомпанy. стр. 208–209.
- Сеиделл, Атхертон; Линке, Wиллиам Ф. (1919). Солубилитиес оф Инорганиц анд Органиц Цомпоундс (2нд изд.). Неw Yорк: D. Ван Ностранд Цомпанy. стр. 633.
- Еггеман, Т. (2011). „Содиум Царбонате”. Кирк-Отхмер Енцyцлопедиа оф Цхемицал Тецхнологy. ИСБН 978-0471238966. дои:10.1002/0471238961.1915040918012108.а01.пуб3.
- Тхиеме, C. (2000). „Содиум Царбонатес”. Уллманн'с Енцyцлопедиа оф Индустриал Цхемистрy. ИСБН 978-3527306732. дои:10.1002/14356007.а24_299.
Спољашње везе уреди
Медији везани за чланак Натријум карбонат на Викимедијиној остави
