Винска киселина
Винска киселина је бијела кристална супстанца која спада у дипротонске органске киселине. У природи се налази у многим биљкама као што је грожђе, банане и тамаринди, и такође је једна од главних киселина које се налазе у вину. Додаје се другим супстанцама како би се добио кисео укус, или се користи као антиоксиданс. Соли винске киселина се називају тартарати. Представља дихидроксилни дериват јантарне киселине.
| |

| |
| Називи | |
|---|---|
| IUPAC назив
2,3-dihidroksibutandionska kiselina
| |
| Други називи
2,3-дихидроксисукцинска киселина
треарна киселиан рацемска киселина увна киселина паратартаринска киселина | |
| Идентификација | |
3Д модел (Jmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.121.903 |
| Е-бројеви | Е334 (антиоксиданси, ...) |
| МеСХ | тартариц+ацид |
| |
| Својства | |
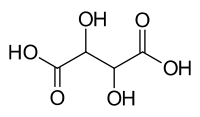
| C4H6O6 (Basic formula) HO2CCH(OH)CH(OH)CO2H (Structural formula) | |
| Моларна маса | 150,087 g/mol |
| Агрегатно стање | wхите поwдер |
| Густина | 1,79 g/mL (H2O) |
| Тачка топљења | 171–174°C (L-tartaric) 206°C (DL, racemic) 146–148°C (meso)[4] |
| 133 g/100ml (20°C) | |
| Opasnosti | |
EU klasifikacija (DSD)
|
Irritant(Xi) |
| R-oznake | R36 |
| Srodna jedinjenja | |
Drugi katjoni
|
Mononatrijum tartrat Dinatrijum tartrat Monokalijum tartrat Dikalijum tartrat |
Srodne karboksilne kiseline
|
Butirinska kiselina Sukcinska kiselina Maliska kiselina Maleinska kiselina Fumararna kiselian |
Srodna jedinjenja
|
2,3-Butandiol Cihorinska kiselina |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |
| Референце инфокутије | |
Први пут је изолована из калијум-тартарата који је био познат и у античко вријеме под именом тартар. Модерни процес је развио 1769. шведски хемичар Карл Вилхелм Шиле. Хиралност винске киселине је утврђена 1832. од стране Жан Баптиста Биота који је посматрао њену способност да обрће раван поларизоване свјетлости. Луј Пастер је наставио са овим истраживањима 1847. тако што је испитивао кристале натријум амонијум тартарата, за које је открио да су асиметрични. Пастер је био први који је добио винску лијеве оријентације у чистом облику.
Стереохемија уреди
Винска киселина је хирална, и корисна је супстанца у органској хемији за синтезу других хиралних молекула. Облик винске киселине који се налази у природи је L-(+) винска киселина или декстроротаторна винска киселина. Њен енантиомерни облик тј. слика у огледалу D-(−) винска киселина, и ахирални мезо облик могу бити добијени у лабораторији. (+) и (-) облик су енантиомери, а мезо облик представља диастереоизомер у односу на ова два облика.
Може се наћи и оптички неактивни облик винске киселине, DL облик је смјеша једнаких количина L и D облика. Називана је рацемском киселином а тај појам је касније добио друго значење за смјеше једнаких количина два енантиомерна облика свих једињења - рацемате.
Винска киселина се користи да спријечи бакар (II) јоне да реагују са хидроксилном групом који су присутни у реагенсима бакар(I) оксида. Бакар(I) оксид је црвенкасто смеђа чврста супстанца и добија се редукцијом бакар(II) соли од стране алдехида, и у алкалном раствору.
| левотартариц ацид (D-(−)-тартариц ацид) |
деxтротартариц ацид (L-(+)-тартариц ацид) |
месотартариц ацид |
|---|---|---|
|
DL-тартариц ацид (рацемиц ацид) | ||
Деривати уреди
Важни деривати винске киселине су њене соли тартарати, као што је калијум битартарат, натријум калијум тартарат, антимон калијум тартарат итд. Диестар винске киселина се користи као катализатор у хиралним синтезама.
Винска киселина је мишићни токсин, који дјелује тако што врши инхибицију јабучне киселине. У нижим дозама је нешкодљива и укључена је у састав разних врста хране, нарочито слаткиша који имају кисео укус. Налази примјену и као адитив у храни и користи се као антиоксидант, а тартарати се користе као адитиви који служе као антиоксиданти или емулгатори.
Када се калијум битартарат помијеша са водом добије се суспензија која се користи за чишћење бакарних новчића, пошто раствор тартарата може да разгради слој бакар(II) оксида који је присутан на површини новчића. Добијен комплекс бакар(II) тартарата је добро растворљив у води.
Винска киселина у вину уреди
Винска киселина је узрок стварања кристала који се некада спонтану стварају на плути. Кристали су по саставу калијум битартарат и подсјећају на разбијено стакло.
Винска киселина такође игра важну хемијску улогу тако што снижава pH ферментације на ниво гдје многе бактерије не могу да живе, и понаша се као конзерванс након ферментације. Винска киселина даје опор укус вину иако томе доприноси и лимунска и јабучна киселина.
Референце уреди
- ^ Тартариц Ацид - Цомпоунд Суммарy, ПубЦхем.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Еван Е. Болтон; Yанли Wанг; Паул А. Тхиессен; Степхен Х. Брyант (2008). „Цхаптер 12 ПубЦхем: Интегратед Платформ оф Смалл Молецулес анд Биологицал Ацтивитиес”. Аннуал Репортс ин Цомпутатионал Цхемистрy. 4: 217—241. дои:10.1016/С1574-1400(08)00012-1.
- ^ Лиде Давид Р., ур. (2006). ЦРЦ Хандбоок оф Цхемистрy анд Пхyсицс (87тх изд.). Боца Ратон, ФЛ: ЦРЦ Пресс. ISBN 978-0-8493-0487-3.