Penaste ćelije
Penaste ćelije, koje se nazivaju i makrofagi puni lipida, su vrsta ćelija koje u sebi sadrže holesterol. Ime su dobili po tome što lipoproteini daju ćeliji penasti izgled.[1] Penaste ćelije mogu da formiraju arterijski plak koji može dovesti do ateroskleroze i izazvati srčani i moždani udar.[2][3][4]
| Penaste ćelije | |
|---|---|
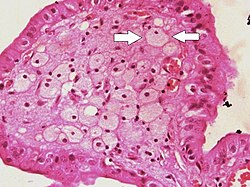 Penaste ćelije (jedna označena strelicama) vidljive u projekcijama nalik na prste u lumen žučne kese u slučaju holesteroloze | |
| Detalji | |
| Prekurzor | monocit-izveden makrofag |
| Identifikatori | |
| MeSH | D005487 |
| FMA | 83586 |
| Anatomska terminologija | |
Penaste ćelije su ćelije pune masti sa fenotipom poput M2 makrofaga. One u sebi sadrže lipoproteine niske gustine (LDL) i mogu se istinski otkriti samo ispitivanjem masnog plaka pod mikroskopom nakon što se on ukloni iz tela.[5] Neke penaste ćelije su izvedene iz ćelija glatkih mišića i predstavljaju ograničen fenotip sličan makrofagu.[6][7][8]
Uprkos povezanosti sa kardiovaskularnim oboljenjima, one možda nisu inherentno opasne.[9]
Patofiziologija uredi
Formiranje penastih ćelija je izazvano brojnim faktorima uključujući:[10]
- nekontrolisano uzimanje modifikovanih lipoproteina niske gustine (LDL),
- povećanje esterifikacije holesterola i
- oštećenje mehanizama povezanih sa oslobađanjem holesterola.[11]
Penaste ćelije se formiraju kada se cirkulišuće ćelije izvedene iz monocita regrutuju na mesto aterosklerotične lezije ili masne naslage u zidovima krvnih sudova. Regrutaciju olakšavaju:
- molekuli P-selektina
- molekuli E-selektin,
- molekul intercelularne adhezije 1 (MICA-1)
- molekul adhezije vaskularnih ćelija 1 (MAVĆ-1).[12]
Monociti su tada u stanju da prodru kroz arterijski zid kao rezultat narušenog integriteta endotela koji povećava permeabilnost. Kada jednom nastanu u subendotelnom prostoru, inflamacijski procesi indukuju diferencijaciju monocita u zrele makrofage.[12] Makrofagi su tada u stanju da internalizuju modifikovane lipoproteine kao što su βVLDL (beta lipoprotein veoma niske gustine), AcLDL (acetilovani lipoprotein niske gustine) i oksidovani lipoprotein niske gustine (okLDL ) kroz njihovo vezivanje za receptore za čišćenje (SRs) kao što su CD-A36 i SR na površini makrofaga.[11] Ovi receptori za čišćenje deluju kao „receptori za prepoznavanje uzoraka“ (PRR) na makrofagima i odgovorni su za prepoznavanje i vezivanje za okLDL, što zauzvrat promoviše formiranje penastih ćelija kroz internalizaciju ovih lipoproteina.[13]
Endocitoza, fagocitoza i pinocitoza su takođe odgovorni za internalizaciju lipoproteina.[14] Kada se internalizuju, očišćeni lipoproteini se transportuju do endozoma ili lizozoma radi razgradnje, pri čemu se estri holesterola (CE) hidrolizuju u neesterifikovani slobodni holesterol (FC) pomoću lizozomalne kisele lipaze (LPL). Slobodni holesterol se transportuje u endoplazmatski retikulum gde se ponovo esterifikuje pomoću ACAT1 (acil-CoA: holesterol aciltransferaza 1) i zatim se skladišti kao kapljice citoplazmatske tečnosti. Ove kapljice su odgovorne za penasti izgled makrofaga, a samim tim i za naziv penastih ćelija.[11]
Penaste ćelije dalje mogu ili da se razgrađuju putem deesterifikacije i lučenja holesterola, ili mogu dalje da podstiču razvoj penastih ćelija i formiranje plaka – proces koji zavisi od ravnoteže slobodnog holesterola i esterifikovanog holesterola.[11]
Uloga medijatora zapaljenja uredi
Mnoge studije su potvrdile ulogu različitih medijatora zapaljenja u početnim proaterogenim procesima, kao što su:[15][16]
- regulacija adhezija molekula za endotelne ćelije,
- vezivanje lipoproteina male gustine za endotelijum,
- aktivacija makrofaga i
- proliferacija vaskularnih ćelija gladkih mišića.
Masna mrlja i zapaljenje
Masna mrlja, koja se razvija na području endotelne disfunkcije, sastoji se od akumulacije penastih ćelija. Nakon stvaranja penastih ćelija, medijatori zapaljenja iniciraju seriju intracelularnih događaja koji uključuju indukciju inflamacijskih citokina. Tako se može održati začarani krug zapaljenja, modifikacije lipoproteina i daljeg zapaljenja u arteriji.[7]
Tranzitorna lezija i inflamacija
U tranzitornoj leziji pojačana fagocitoza oksidizovanih lipoproteina male gustine dodatno aktivira monocit i makrofage i samim tim olakšava i pogoršava inflamacijsku reakciju.
Fibrozni plak i zapaljenje
Inflamacijski proces, aktivnost metaloproteinaza koje razgrađuju matriks, agregacija trombocita i proliferacija ćelija glatkih mišića imaju glavnu ulogu u razvoju fibroznog plaka.
Komplikovana lezija i inflamacija
Istraživanjima je dokazano da je zapaljenje tesno povezano s razvojem rupture aterosklerotičnog plaka.[17]
Kompozicija uredi
Lipoprotein niske gustine (LDL) i holesterol (LDL-C — takođe poznat kao „loš“ holesterol) i posebno modifikovani oblici LDL holesterola, kao što su oksidovani, glikovani ili acetilovani LDL, sadrži penasta ćelija – marker ateroskleroze.[18] Sam unos LDL-C ne izaziva formiranje penastih ćelija; međutim, kointernalizacija LDL-C sa modifikovanim LDL-om u makrofagima može dovesti do razvoja penastih ćelija. Modifikovani LDL utiče na intracelularnu trgovinu i metabolizam prirodnog LDL, tako da ne moraju svi LDL biti modifikovani za formiranje penastih ćelija kada su nivoi LDL visoki.[14]
Održavanje penastih ćelija i naknadno napredovanje nakupljanja plaka uzrokovano je lučenjem hemokina i citokina iz makrofaga i penastih ćelija. Penaste ćelije luče proinflamatorne citokine kao što su interleukini: IL-1, IL-6; faktor tumorske nekroze (TNF); hemokini: hemokinske ligande 2, CCL5, CKSC-hemokin ligand 1 (CKSCL1); kao i faktori retencije makrofaga.[13] Makrofagi u oblasti aterosklerotične regije imaju smanjenu sposobnost migriranja, što dalje podstiče formiranje plaka jer su u stanju da luče citokine, hemokine, reaktivne vrste kiseonika (ROS) i faktore rasta koji stimulišu modifikovano unos lipoproteina u vaskularne glatke mišićne ćelije (VSMC) proliferacija.[9][19][12] VSMC takođe može da akumulira estre holesterola.[9]
U hroničnoj hiperlipidemiji, lipoproteini se agregiraju unutar intime krvnih sudova i oksiduju dejstvom slobodnih radikala kiseonika koje stvaraju ili makrofagi ili endotelne ćelije. Makrofagi gutaju oksidovane lipoproteine niske gustine (LDL) endocitozom preko receptora za čišćenje, koji se razlikuju od LDL receptora. Oksidovani LDL se akumulira u makrofagima i drugim fagocitima, koji su tada poznati kao penaste ćelije.[20] Penaste ćelije formiraju masne trake plakova ateroma u tunici intimi arterija.
Penaste ćelije same po sebi nisu opasne, ali mogu postati problem kada se akumuliraju u određenim žarištima stvarajući tako nekrotični centar ateroskleroze. Ako fibrozni čep koji sprečava izlivanje nekrotičnog centra u lumen suda pukne, može doći do stvaranja tromba koji može dovesti do začepljenja manjih sudova embolije. Okluzija malih sudova dovodi do ishemije i doprinosi moždanom udaru i infarktu miokarda, dva od vodećih uzroka smrti uzrokovane kardiovaskularnim bolestima.[9]
Penaste ćelije su veoma male veličine i mogu se zaista otkriti samo ispitivanjem masnog plaka pod mikroskopom nakon što se ukloni iz tela, tačnije iz srca. Detekcija obično uključuje bojenje delova aortnog sinusa ili arterije sa Oil Red O (ORO), praćeno kompjuterskim snimanjem i analizom; ili primenom Nilskog crvenog bojenja. Pored toga, fluorescentna mikroskopija ili protočna citometrija se mogu koristiti za otkrivanje unosa OkLDL kada je OkLDL obeležen 1,1′-dioktadecil-3,3,3′3′-tetra-metilindocijanid perholoratom (DiI-OkLDL).[5]
Autoimunost se javlja kada telo počne da napada samo sebe. Veza između ateroskleroze i autoimunosti su plazmacitoidne dendritske ćelije (pDC), koje doprinose ranim fazama formiranja aterosklerotskih lezija u krvnim sudovima oslobađanjem velikih količina interferona tipa 1 (INF). Stimulacija pDC-a dovodi do povećanja makrofaga prisutnih u plakovima. Međutim, tokom kasnijih faza progresije lezije, pokazalo se da pDC imaju zaštitni efekat aktivacijom T ćelija i Treg funkcije; što dovodi do supresije bolesti.[21]
Degradacija uredi
Degradaciju penastih ćelija ili tačnije razgradnju esterifikovanog holesterola, olakšavaju brojni receptori i putevi efluksa. Esterifikovani holesterol iz citoplazmatskih tečnih kapljica se ponovo hidrolizuje u slobodni holesterol pomoću kisele holesterol esteraze. Slobodni holesterol se zatim može izlučiti iz makrofaga efluksom u ApoA1 i ApoE diskove preko ABCA1 receptora. Ovaj put obično koriste modifikovani ili patološki lipoproteini kao što su AcLDL, OkLDL i βVLDL. Penaste ćelija se takođe mogu transportovati u odeljak za reciklažu kroz efluks do ApoA1 koji sadrži HDL (lipoproteine visoke gustine) putem vodene difuzije ili transporta kroz SR-B1 ili ABCG1 receptore. Dok ovaj put mogu da koriste i modifikovani lipoproteini, holesterol dobijen iz LDL-a može koristiti samo ovaj put za izlučivanje penastih ćelija. Razlike u putevima izlučivanja između tipova lipoproteina uglavnom su rezultat razdvajanja holesterola u različite oblasti.[6][1][22]
Zarazne bolesti uredi
Penasti makrofagi se takođe nalaze u bolestima uzrokovanim patogenima koji perzistiraju u telu, kao što su klamidija, toksoplazma ili mikobakterijum tuberkuloze. Kod tuberkuloze, bakterijski lipidi onemogućavaju makrofage da ispumpaju višak LDL-a, uzrokujući da se pretvore u penaste ćelije oko granuloma tuberkuloze u plućima. Holesterol je bogat izvor hrane za bakterije. Kako makrofagi umiru, masa holesterola u centru granuloma postaje sirasta supstanca koja se zove kazeum.[23]
Druga stanja uredi
Penaste ćelije mogu da se formiraju oko silikona koji je iscureo iz grudnih implantata.[24] Alveolarni makrofagi opterećeni lipidima, takođe poznati kao plućne penaste ćelije, vide se u uzorcima bronhoalveolarnog ispiranja kod nekih respiratornih bolesti.[25]
Vidi još uredi
Izvori uredi
- ^ a b „Foam cells - Latest research and news | Nature”. www.nature.com. Pristupljeno 2022-06-19.
- ^ Hotamisligil GS (april 2010). „Endoplasmic reticulum stress and atherosclerosis”. Nature Medicine. 16 (4): 396—9. PMC 2897068 . PMID 20376052. doi:10.1038/nm0410-396.
- ^ Yu XH, Fu YC, Zhang DW, Yin K, Tang CK (septembar 2013). „Foam cells in atherosclerosis”. Clinica Chimica Acta. 424: 245—52. PMID 23782937. doi:10.1016/j.cca.2013.06.006 .
- ^ Oh J, Riek AE, Weng S, Petty M, Kim D, Colonna M, Cella M, Bernal-Mizrachi C (april 2012). „Endoplasmic reticulum stress controls M2 macrophage differentiation and foam cell formation”. The Journal of Biological Chemistry. 287 (15): 11629—41. PMC 3320912 . PMID 22356914. doi:10.1074/jbc.M111.338673 .
- ^ a b Xu, Suowen; Huang, Yan; Xie, Yu; Lan, Tian; Le, Kang; Chen, Jianwen; Chen, Shaorui; Gao, Si; Xu, Xiangzhen; Shen, Xiaoyan; Huang, Heqing; Liu, Peiqing (2010). „Evaluation of foam cell formation in cultured macrophages: An improved method with Oil Red O staining and DiI-oxLDL uptake”. Cytotechnology. 62 (5): 473—481. PMC 2993859 . PMID 21076992. doi:10.1007/s10616-010-9290-0.
- ^ a b Yi Li, Huan Zhu, Qianyu Zhang, Ximeng Han, Zhenqian Zhang, Linghong Shen, Lixin Wang, Kathy O. Lui, Ben He & Bin Zhou Smooth muscle-derived macrophage-like cells contribute to multiple cell lineages in the atherosclerotic plaque Cell Discovery volume 7, Article number: 111 (2021)
- ^ a b Yuzhou Gui, Hongchao Zheng, and Richard Y. Cao, Foam Cells in Atherosclerosis: Novel Insights Into Its Origins, Consequences, and Molecular Mechanisms Front Cardiovasc Med. 2022; 9: 845942.
- ^ Pryma, Collin S.; Ortega, Carleena; Dubland, Joshua A.; Francis, Gordon A. (april 2019). „Pathways of smooth muscle foam cell formation in atherosclerosis”. Current Opinion in Lipidology (na jeziku: engleski). 30 (2): 117—124. ISSN 0957-9672. PMID 30664015. S2CID 58633787. doi:10.1097/MOL.0000000000000574.
- ^ a b v g Linton MF, Yancey PG, Davies SS, et al. The Role of Lipids and Lipoproteins in Atherosclerosis. [Updated 2015 Dec 24]. In: De Groot LJ, Chrousos G, Dungan K, et al., editors. Endotext [Internet]. South Dartmouth (MA): MDText.com, Inc.; 2000-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK343489
- ^ Brevetti, G., Schiano, V., Chiariello, M. (2008) Endothelial dysfunction: A key to the pathophysiology and natural history of peripheral arterial disease?. Atherosclerosis, 197(1): 1-11
- ^ a b v g Yu, Xiao-Hua; Fu, Yu-Chang; Zhang, Da-Wei; Yin, Kai; Tang, Chao-Ke (2013). „Foam cells in atherosclerosis”. Clinica Chimica Acta. 424: 245—252. PMID 23782937. doi:10.1016/j.cca.2013.06.006..
- ^ a b v Bobryshev, Yuri V.; Ivanova, Ekaterina A.; Chistiakov, Dimitry A.; Nikiforov, Nikita G.; Orekhov, Alexander N. (2016). „Macrophages and Their Role in Atherosclerosis: Pathophysiology and Transcriptome Analysis”. BioMed Research International. 2016: 1—13. PMC 4967433 . PMID 27493969. doi:10.1155/2016/9582430 ..
- ^ a b Moore, Kathryn J.; Sheedy, Frederick J.; Fisher, Edward A. (2013). „Macrophages in atherosclerosis: A dynamic balance”. Nature Reviews Immunology. 13 (10): 709—721. PMC 4357520 . PMID 23995626. doi:10.1038/nri3520..
- ^ a b Jones, Nancy L.; Reagan, Jerry W.; Willingham, Mark C. (2000). „The Pathogenesis of Foam Cell Formation”. Arteriosclerosis, Thrombosis, and Vascular Biology. 20 (3): 773—781. PMID 10712403. doi:10.1161/01.atv.20.3.773..
- ^ Vucevic, Danijela; Radak, Djordje; Radosavljevic, Tatjana; Mladenovic, Dusan; Milovanovic, Ivan (2012). „Inflammatory process in atherogenesis: New facts about old flame”. Medicinski Pregled. 65 (9–10): 388—395. PMID 23214332. doi:10.2298/MPNS1210388V..
- ^ Libby, P. (2007) Inflammatory Mechanisms: The Molecular Basis of Inflammation and Disease. Nutrition Reviews, 65(12): 140-146
- ^ Radović, V.V. (2010) Prediktivna vrednost markera inflamacije i markera nekroze miokarda u akutnom koronarnom sindromu. Medicinski pregled, vol. 63, br. 9-10, str. 662-667
- ^ Oh, Jisu; Riek, Amy E.; Weng, Sherry; Petty, Marvin; Kim, David; Colonna, Marco; Cella, Marina; Bernal-Mizrachi, Carlos (2012). „Endoplasmic Reticulum Stress Controls M2 Macrophage Differentiation and Foam Cell Formation”. Journal of Biological Chemistry. 287 (15): 11629—11641. PMC 3320912 . PMID 22356914. doi:10.1074/jbc.M111.338673 ..
- ^ Shen, Chun-Mei; Mao, Simon J.T.; Huang, G.Steve; Yang, Ping-Cheng; Chu, Rea-Min (2001). „Stimulation of smooth muscle cell proliferation by ox-LDL- and acetyl LDL-induced macrophage-derived foam cells”. Life Sciences. 70 (4): 443—452. PMID 11798013. doi:10.1016/s0024-3205(01)01428-x..
- ^ Kumar, Abbas; Fausto, Aster (2010). "11". Robbins and Cotran: Pathologic Basis of Disease (Eighth Edition International ed.). Philadelphia: Saunders Elsevier. ISBN 978-1-4160-3121-5. str. 500–501..
- ^ Döring Y, Zernecke A (2012). "Plasmacytoid dendritic cells in atherosclerosis". Frontiers in Physiology. 3: 230.
- ^ Wang MD, Kiss RS, Franklin V, McBride HM, Whitman SC, Marcel YL (mart 2007). „Different cellular traffic of LDL-cholesterol and acetylated LDL-cholesterol leads to distinct reverse cholesterol transport pathways”. Journal of Lipid Research. 48 (3): 633—45.
- ^ Russell DG, Cardona PJ, Kim MJ, Allain S, Altare F (septembar 2009). „Foamy macrophages and the progression of the human tuberculosis granuloma”. Nature Immunology. 10 (9): 943—8..
- ^ van Diest, P J; Beekman, W H; Hage, J J (1998). „Pathology of silicone leakage from breast implants”. Journal of Clinical Pathology. 51 (7): 493—497..
- ^ Fessler, Michael B. (2017). „A New Frontier in Immunometabolism. Cholesterol in Lung Health and Disease”. Annals of the American Thoracic Society. 14 (Supplement_5): S399—S405. ISSN 2329-6933. PMC 5711269 . PMID 29161079. doi:10.1513/AnnalsATS.201702-136AW.}
Literatura uredi
- Vučević, D., Radak, Đ., Radosavljević, T., Mladenović, D., Milovanović, I. (2008) Ateroskleroza u svetlu postojećih naučnih teorija. Medicinska istraživanja, vol. 42, br. 2, str. 29-36
- Vučević, D., Radak, Đ., Radosavljević, T., Mladenović, D., Milovanović, I. (2009) Fibrozni plak kao metabolički stadijum aterogeneze. Medicinska istraživanja, vol. 43, br. 1, str. 35-47
Spoljašnje veze uredi
| Molimo Vas, obratite pažnju na važno upozorenje u vezi sa temama iz oblasti medicine (zdravlja). |