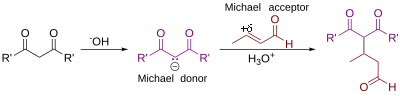
Мајклова адиција
Мајклова адиција (Мајклова реакција) је нуклеофилна адиција карбањона или другог нуклеофила[1][2][3] у једињење са алфа, бета незасићеним карбонилом. Она припада већој класи коњугатних адиција. Она је један од најкориснијих метода за благо формирање C-C веза.[4] Постоје многе асиметричне варијанте.[5][6]
У овом шематском приказу R и R' супституенти нуклеофила (Мијкловог донора) су електрон-одвлачеће групе, на пример ацил и цијано. Оне чине метиленски водоник киселим, чиме се формира карбањон током реакције са базом B:. Супституент активираног алкена (Мајклов акцептор), је обично кетон, тако да је то енон, мада он такође може да буде нитро група.
Дефиниција
уредиОву реакцију је оригинално дефинисао Артур Мајкл,[7][8] као адицију енолата кетона или алдехида на β угљеник α,β-незасићених карбонилних једињења. Новија дефиниција, коју је предложио Кохлер,[9] је 1,4-адиција двоструко стабилизованог угљеничног нуклеофила на α,β-незасићено карбонилно једињење. Неки примери нуклеофила су бета-кетоестри, малонати, и бета-цијаноестри. Резултујући продукт садржи веома корисни 1,5-диоксигенисани мотив.
Класични примери Мајклове реакције су реакције између:
- диетил малоната (Мајкловог донора) и диетил фумарата (Мајкловог акцептора),[10]
- меситил оксида и диетил малоната[11]
- диетил малоната и метил кротоната[12]
- 2-нитропропан и метил акрилата[13]
- етил фенилцијаноацетат и акрилонитрил[14] и
- нитропропан и метил винил кетон.[15]
Мајклова адиција је важан атомски економичан метод за дијастереоселективно и енантиоселективно формирање C-C везе. Класична тандем секвенца Мајклове и алдолне адиције је Робинсонова анулација.
Механизам
уредиРеакциони механизам је једињења 1, где су R алкокси остаци, са нуклеофилом[4]:
Депротонација 1 базом доводи до стабилизације карбањона (2) његовим електрон-одвлачећим групама. Структуре 2а до 2c су три резонантне структуре ове молекулске врсте, две од којих имају енолатне јоне. Овај нуклеофил реагује са електрофилним алкеном 3 да формира 4 у реакцији коњугатне адиције. Протонска апстракција са протоноване базе (или растварача) енолатом 4 до 5 је финални корак.
Референце
уреди- ^ Литтле, Р. Даниел; Масједизадех, Мохаммад Р.; Wаллqуист, Олоф; МцЛоугхлин, Јим I. (1995). „Тхе Интрамолецулар Мицхаел Реацтион”. Органиц Реацтионс. стр. 315—552. ИСБН 0471264180. дои:10.1002/0471264180.ор047.02.
- ^ Матхер, Б. .; Висwанатхан, К. .; Миллер, К. .; Лонг, Т. (2006). „Мицхаел аддитион реацтионс ин мацромолецулар десигн фор емергинг тецхнологиес”. Прогресс ин Полyмер Сциенце. 31 (5): 487—531. дои:10.1016/ј.прогполyмсци.2006.03.001.
- ^ „Mather 2006 reprint” (ПДФ). Архивирано из оригинала (ПДФ) 26. 07. 2011. г. Приступљено 08. 10. 2011.
- ^ а б Мицхаел Аддитион | ПхармаXЦханге.инфо
- ^ Иан Хунт. „Цхаптер 18: Енолс анд Енолатес – Тхе Мицхаел Аддитион реацтион”. Университy оф Цалгарy.
- ^ Цлаyден, Јонатхан; Греевес, Ницк; Wаррен, Стуарт; Wотхерс, Петер (2001). Органиц Цхемистрy (I изд.). Оxфорд Университy Пресс. ИСБН 978-0-19-850346-0.
- ^ Артхур Мицхаел (1887). „Уебер дие Аддитион вон Натриумацетессиг- унд Натриуммалонсäуреäтхерн зу ден Аетхерн унгесäттигтер Сäурен”. Јоурнал фüр Практисцхе Цхемие. 35 (1): 349—356. дои:10.1002/прац.18870350136.
- ^ Артхур Мицхаел (1894). „Уебер дие Аддитион вон Натриумацетессиг- унд Натриуммалонсäуреäтхер зу ден Аетхерн унгесäттигтер Сäурен”. Јоурнал фüр Практисцхе Цхемие. 49 (1): 20—29. дои:10.1002/прац.18940490103.
- ^ Kohler. (J. Am. Chem. Soc., 1907, 37, 385; ibid., 1935, 57, 1316.
- ^ Х. Т. Цларке анд Т. Ф. Мурраy (1941). „1,1,2,3-Пропанететрацарбоxyлиц ацид, тетраетхyл естер”. Орг. Сyнтх.; Цолл. Вол., 1, стр. 272
- ^ Р. L. Схринер анд Х. Р. Тодд (1943). „1,3-Цyцлохеxанедионе, 5,5-диметхyл-”. Орг. Сyнтх.; Цолл. Вол., 2, стр. 200
- ^ Јамес Цасон (1963). „β-Метхyлглутариц анхyдриде”. Орг. Сyнтх.; Цолл. Вол., 4, стр. 630
- ^ Р. Б. Моффетт (1963). „Метхyл γ-Метхyл-γ-нитровалерате”. Орг. Сyнтх.; Цолл. Вол., 4, стр. 652
- ^ Е. C. Хорнинг анд А. Ф. Финелли (1963). „α-Пхенyл-α-царбетхоxyглутаронитриле”. Орг. Сyнтх.; Цолл. Вол., 4, стр. 776
- ^ „Цонверсион оф Нитро то Царбонyл бy Озонолyсис оф Нитронатес: 2,5-Хептанедионе”. Орг. Сyнтх. 1988.; Цолл. Вол., 6, стр. 648