Слободни електронски пар
У хемији, слободни пар је пар валентних електрона без хемијске везе, То су електрони које атом не дели са другим атомима. Они су лоцирани на спољашњем електронском слоју атома, тако да су слободни парови подскуп молекулских валентних електрона. Они се могу идентификовати прегледом спољашњег енергијског нивоа атома. Слободни електронски парови се састоје од парова електрона за разлику од појединачних електрона, који се јављају у непопуњеним атомским орбиталама. Укупни број валентних електрона једињења је збир броја слободних парова и броја везујућих електрона.[1][2]
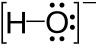
Примери уреди
Један слободни паре се може наћи на атомима азотних група као што је азот у амонијаку, а два слободна пара се могу наћи на атомима у халкогених група као што је кисеоник у води. Халогени могу да имају три слободна пара, нпр. у хлороводоничној киселини.
У једноставној електронској теорији валенце атом кисеоника у води је sp3 хибридизован са слободним паровима у sp3 орбиталама. Угао H–O–H везе је 104.5°, што је мање од 109° за правилни тетраедарски угао. То се може објаснити репулзивним интеракцијама између слободних парова.[3][4][5]
Види још уреди
Референце уреди
- ^ Паркес, Г.D. & Пхил, D. (1973). Мелорова модерна неорганска хемија. Београд: Научна књига.
- ^ Хоусецрофт, C. Е.; Схарпе, А. Г. (2008). Инорганиц Цхемистрy (3. изд.). Прентице Халл. ИСБН 978-0-13-175553-6.
- ^ Organic Chemistry Marye Anne Fox , James K. Whitesell 2nd Edition 2001
- ^ МцМуррy Јохн Е. (1992). Фундаменталс оф Органиц Цхемистрy (3рд изд.). Белмонт: Wадсwортх. ISBN 0-534-16218-5.
- ^ Concise Inorganic Chemistry J.D. Lee 4th Edition 1991