Портал:Fizička hemija/Izabrani članak april
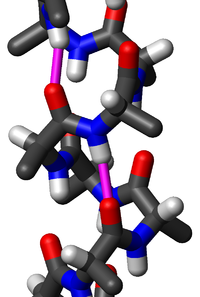
Alfa heliks (α-heliks) je desnogira zavojita konformacija koja podseća na oprugu, kod koje svaka alfa-amino (N–H) grupa stvara vodoničnu vezu sa alfa-karbosilnom (C=O) grupom aminokiseline 4 ostatka ranije ( vodonična veza).
Polipeptidni lanac može formirati različite vrste heliksa koje se razlikuju po broju uvijanja lanca i po razmaku između uvijenih segmenata polipeptida u heliksu. One se obrazuju spontano, jer su energetski najsiromašnije, a time i najstabilnije konformacije proteina. Heliks mogu da obrazuju i L- i D-aminokiseline, ali samo jedne ili druge jer heliks ne može da se obrazuje od peptidnog lanca koji sadrži smešu ostataka L- i D-aminokiselina. Heliksi mogu biti desnogiri i levogiri, zavisno od toga na koju stranu se uvrće proteinski lanac; desnogiri heliks je određen pravcem u kome se okreću prsti desne ruke kada se palac postavi na osu heliksa u pravcu u kome se on gradi. L-aminokiseline su češće u prirodi i one mogu da obrazuju i levogiri i desnogiri heliks, ali većina poznatih heliksa u prirodi su desnogiri. Međutim, samo jedna heliksna konformacija istovremeno zadovoljava optimalne uslove uvijanja koja daje osnovu za lako uspostavljanje intramolekulskih vodoničnih veza između bliskih konstituenata peptidne veze. Ta forma se naziva α-heliks i najčešće je prisutna u proteinima živih sistema.
