Vajnrebova sinteza ketona
Vajnrebova sinteza ketona ili Vajnreb–Namova ketonska sinteza je hemijska reakcija koja se koristi u organskoj hemiji za stvaranje veza ugljenik-ugljenik. Otkrili su je 1981. Stiven M. Vajnreb i Stiven Nam kao metod za sintezu ketona.[1] Prvobitna reakcija je uključivala dve naknadne nukleofilne acilne supstitucije: konverziju kiselog hlorida sa N,O-dimetilhidroksilaminom, da bi se formirao Vajnreb-Namov amid, i naknadni tretman ovog jedinjenja organometalnim reagensom kao što je Grignardov reagens ili organolijumski reagens. Nam i Vajnreb su takođe izvestili o sintezi aldehida redukcijom amida sa viškom litijum aluminijum hidrida (videti redukciju amida).

Glavna prednost ove metode u odnosu na adiciju organometalnih reagenasa tipičnijim acil jedinjenjima je u tome što se izbegava uobičajeni problem prekomernog dodavanja. Za ove poslednje reakcije, dva ekvivalenta dolazeće grupe se dodaju da bi se formirao alkohol, a ne keton ili aldehid. Ovo se dešava čak i ako su ekvivalenti nukleofila strogo kontrolisani.
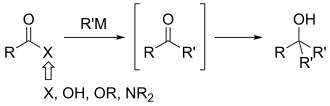
Vajnreb-Namov amid je od tada prihvaćen u redovnoj upotrebi od strane organskih hemičara kao pouzdan metod za sintezu ketona. Ove funkcionalne grupe su prisutne u velikom broju prirodnih proizvoda i mogu pouzdano da reaguju da formiraju nove veze ugljenik-ugljenik ili da se konvertuju u druge funkcionalne grupe. Ovaj metod je korišćen u brojnim sintezama, uključujući makrofelide A i B,[2] amfidinolid J,[3] i spirofungine A i B.[4]
Reference
уреди- ^ Nahm, S.; Weinreb, S. M. (1981), „N-methoxy-n-methylamides as effective acylating agents”, Tetrahedron Letters, 22 (39): 3815—3818, doi:10.1016/s0040-4039(01)91316-4
- ^ Paek, S.-M.; Seo, S.-Y.; Kim, S.-H.; Jung, J.-W.; Lee, Y.-S.; Jung, J.-K.; Suh, Y.-G. (2005), „Concise Syntheses of (+)-Macrosphelides A and B”, Organic Letters, 7 (15): 3159—3162, PMID 16018610, doi:10.1021/ol0508429
- ^ Barbazanges, M.; Meyer, C.; Cossy, J. (2008), „Total Synthesis of Amphidinolide J”, Organic Letters, 10 (20): 4489—4492, PMID 18811171, doi:10.1021/ol801708x
- ^ Shimizu, T.; Satoh, T.; Murakoshi, K.; Sodeoka, M. (2005), „Asymmetric Total Synthesis of (−)-Spirofungin A and (+)-Spirofungin B”, Organic Letters, 7 (25): 5573—5576, PMID 16320994, doi:10.1021/ol052039k