Јуингов сарком
Јуингов (Ewing) сарком (енгл. Ewing sarcoma family of tumors (ESFT)) малигни је тумор коштаног али и меког ткива, који као и остали експанзивни тумори може да да удаљене метастазе. Поједини саркоми из фамилија ових тумор (ESFT) могу да буде мезодермалног и ектодермалног порекла. Овај сарком костију добио је назив по Амерички патологу Џејмсу Јуингу (James Ewing 1866—1943) који га је описао још 1921. године када је установио да постоји разлика између њега и лимфома, као и да саркоми кости малих ћелија реагују на радијум импланте, за разлику од остеосаркома.[1][2][3][4]
| Јуингов сарком | |
|---|---|
 | |
| Класификација и спољашњи ресурси | |
| Специјалност | Онкологија |
Мада је примарно коштани тумор, Јуингов сарком може да израста и из меких ткива као екстраосални Јуингов (Ewing) сарком (EES) или се може појавити као диференциранији облик познат под именом периферни примитивни неуроекодермални тумор (PPNET).[5]
Шта је узрок Јуинговог саркома није у потпуности познато али се у бројним истраживањима као могући етиолошки фактор наводе механизми транслокација између хромозома 11 и 22, 7 и 22, 21 и 22. Полазећи од чињенице да је код Јуинговог саркома поремећене генетике у смислу промена у транслокацијама, ови тумори се разврставају у групу неуроендокриних тумора.[6]
Сви тумори из ове групе саркома по неким ауторима сврставају се у Јуингову (Ewing) породицу тумора које чине; костни и екстраосални облик Јуинговог саркома, примитивни неуроектодермални тумор и Аскин тумор (PNET зида грудног коша), јер деле реципрочну транслокацију (11;22)(q24;q12) и потичу од заједничке примордијалне ћелије. Зато они носе и општеприхваћени назив Јуинг (Ewing) фамилија тумора (енгл. Ewing sarcoma family of tumors (ESFT))[7]
Епидемиологија
уредиЈуингов сарком је по учесталости јављања као други тумор коштаног ткива код деце и адолесцената и најмалигнији коштани тумор у дечјем добу.
- Морбидитет
Учесталост оболевања је 0,3 болесника на 1.000.000 деце млађе од 3 године и 4,6 деце на 1.000.000 између 15 и 19 година живота. Просечна учесталост оболевања је испод 2 болесника на 1.000.000 деце на годину.
Јуингов сарком је чешћи ју другој декади живота. У 75% случајева дијагностикује се пре 20 године живота а у 90% пре 30 године.
- Полне разлике
Мушко женски однос код деце је 1,5 : 1.
Опстанак код локализованог тумора је 60-70% оболелих, 30% преживљавање је код болесника са метастазама у плућима, док је преживљавање мање од 10% код болесника са метастазама на другим локацијама у телу.
У питању је други по заступљености малигни тумор костију код млађих особа, са највећим морталитетом.
Етиопатогенеза
уредиЈуингов сарком, који се може јавити код деце од раног узраста па све до старије животне доби, најчешће је присутан у дечјем или раном адолесцентном добу, са највећом учесталошћу између 10 и 20 године живота.
Према бројним истраживањима код Јуинговог саркома генетска размена између хромозома може изазвати ћелије да постану канцерогене. У већини случајева (85%) сарком је резултат транслокације између хромозома 11 и 22, који је спој EWS гена (РНА-везујућег протеина) на хромозому 22. и FLI1-гена (енгл. Friend leukemia integration 1 transcription factor), хромозома 11.[8]
EWS и FLI1 гени функционишу као главни регулатори процеса малигне алтерације код Јуинговог саркома.[9] Друге транслокације гена код овог тумора су на т(21;22),[10] и т(7;22).[11]
Ћелије Јуингов сарком позитивне су на CD99 aнтиген и MIC2 (појединачни тип-1 глукопротеина), и негативна за PTPRC (протеин тирозин фосфатазни тип рецептора).[12]
- Патохистологија
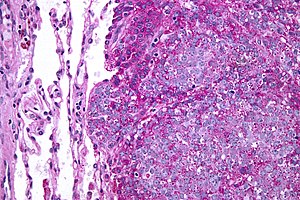
За овај малигни тумор пљоснатих и дугих костију, са недиференцирано малим округлим ћелијама све до 1980-их мислило са да има ендотелијално порекло, но новији подаци из истраживања упућују да се највероватније ради о најнезрелијој ћелији из неуроектодерма (постганглијских парасимпатичких холинергичких неурона).[13]
- Локализација
Јуингов сарком најчешће је локализован на; дијафизама дугих костију (бутна и надлакатна кост), пљоснатим костима трупа (карлица, ребро, кључна кост), али се може наћи у готово било ком делу тела.
Клиничка слика
уредиЈуингов тумор на месту позиционирања изазива локалну бол у костима или оток меких ткива., што су обично и први симптоми Јуинговог саркома, због којих се болесник јавља лекару.
За разлику од остеосаркома код овог тумора клиничка слика се карактерише следећим симптомимима:
- Чести интермитентни пораст телесне температуре
- Губитак на телесној тежини
- Општа слабост, малаксалост, која уједно указују и на појаву метастазе.
- Појава метастаза. Око 25% болесника има при почетку болести хематогене метастазе у плућима, костима, коштаној сржи или плеури (плућној марамици)
Дијагноза
уредиРендгенски снимци код Јуинговог саркома приказују тумор дијафиза који се протеже све до метафиза. На коштаном ткиву постоје мешани литички и склерозирајући дефекти, или ламеле са стварањем нове кости. Око 2/3 болесника има и туморску масу која се састоји од меког ткива, а понекад су присутне патолошке фрактуре.[14]
Компјутеризована томографија (ЦТ) плућа и сцинтиграфија кости са техницијем неопходна је за тражење метастаза. Компјутеризована томографија кости на којој се налази примарни тумор даје корисне информације о проширењу болести на мека ткива и медуларну шупљину. Ови подаци су од посебног значаја за планирање оперативног захвата, у току којег се отклања тумором захвећен део кости уз максимално очување оболелог уда.[15]
Цитогенетска и молекулске анализе туморског ткива најчешће показују пет реципрочних транслокација, а најзаступљеније су:
- т(11;22) (к24; к12), која је најчешћа, а резултује фузијом гена EVS-FLI1 - (90-95% тумора)
- т(21;22 ) (к22;к12) која резултује фузијом гена EVS-ERG (5-10% тумора).
RT-PCR-ом и FISH-ом могуће је открити специфичне преписе EVS-FLI1 и EVS-ERG које изражава тумор. Ове методе олакшавају дијагнозу која је до сада због недостатка специфичне патолошке слике углавном била заснована према локализацији тумора и искључивању других облика тумора малих округлих ћелија.[16]
Дијагностика овог саркома обавезно захтева и анализу коштане сржи.
Диференцијална дијагноза
уредиКако је Јуингов сарком релативно редак, он се често не разматра у диференцијалној дијагнози све до биопсије, која открива неоплазму познату као мали округли тумор плавих ћелија. Малигнитет се обично у диференцијалној дијагнози пре биопсија не разматра. Из тог разлога, консултације са педијатријским онкологом је од великог значаја.[17]
На Јуингов саркома у диференцијалној дијагнози треба увек посумњати уколико је пацијент старости 10-30 година и има меко ткивну или коштану неоплазму.[17]
- Диференцијална дијагноза Јуинговог саркома,[17] укључује
- Неорабдомиосарком меких ткива
- Дечији неуробластом
- Дечији неходџкинов лимфом
- Дечији остеомијелитис
- Дечији остеосарком
- Дечији рабдомиосарком
- Рахитис
Терапија
уредиЈуингов сарком се обавезно лечи као системско обољење, комбинацијом хируршких интервенција, зрачења и хемотерапије. Тиме се постиже контролисани раст примарног тумора, и ерадикација удаљених метастаза.[18]
Зрачном терапијом третира се цела дужина захваћене кости, дозом од 6.000-7.000 cGy. Међутим како те дозе могу довести до јаких функционалних оштећења, комбиновањем радиотерапије са хемотерапијом, дозе зрачења се могу смањити на 4.000-5.000 cGy, без већег или скоро никаквог утицаја на коначни исход лечења.[19]
Прогноза
уредиУкупна стопа преживљавања болесника је 60%. За болеснике са локализованом формом болести стопа преживљавања достиже и 70%, док је код болесника са метастатском болешћу, дугорочна стопа преживљавања мања од 25% .[20]
Преживљење болесника код Јуинговог саркома је око 15% ако се лечење спроведи само хируршким захватом.[21] Код примене радиотерапије, као изоловане методе, преживљавање има слабије резултате и креће се око 10%.[22]
- Локализација тумора
Са најбољом прогнозом код Јуинговог саркома су тумори локализовани на дисталним деловима удова и аксијални скелет (централна локализација - кранијум, клавикуле, ребра, кичмени пршљенови). Проксимални делови удова, а нарочито карлични појас, повезани су са неповољном прогнозом болести.[23]
- Величина туморске масе
Величина (запремина) тумора је значајна за прогнозу болести. Међутим истраживања показују да веће лезије показују тенденцију да се јављају на местима са неповољном прогнозом, тако да је тешко утврдити који фактор је доминантан.[23]
- Узраст и пол
Деца млађег узраста имају дужи период преживљавања без рецидива болести него адолесценти или млади одрасли људи.[23]
Особе женског пола са Јуинговим тумором кости имају бољу прогнозу у односу на болеснике мушког пола.[23]
Извори
уреди- ^ synd/2367 на сајту Who Named It
- ^ Ewing, J. (1921). „Diffuse endothelioma of bone”. Proceedings of the New York Pathological Society. 21: 17—24.
- ^ J. Ewing: Review and classification of bone sarcoma. Archives of Surgery, Chicago, 1922, 4: pp. 485-533.
- ^ J. Ewing: Further report on endothelial endothelioma of bone. Proceedings of the New York Pathological Society, 1924, 24: pp. 93-101.
- ^ Le Deley MC, Delattre O, Schaefer KL, et al. Impact of EWS-ETS fusion type on disease progression in Ewing's sarcoma/peripheral primitive neuroectodermal tumor: prospective results from the cooperative Euro-E.W.I.N.G. 99 trial. J Clin Oncol. 2010 Apr 20. 28(12):1982-8. [Medline].
- ^ Stevanović V. Ewing sarkom kod dece: prognoza bolesti u zavisnosti od epidemioloških karakteristika tumora i načina lečenja [magistarski rad]. Beograd: Medicinski fakultet; 2003.
- ^ Zoran VUKAŠINOVIĆ, Vladan STEVANOVIĆ, Duško SPASOVSKI, Savremeno shvatanje Juingovog (EWING) sarkoma, Srpski arhiv za celokupno lekarstvo BIBLID: 0370-8179, 134(2006) 7-8, p. 348-355 Архивирано на сајту Wayback Machine (5. октобар 2015)
- ^ medicine, s cecil. Goldman (24th ed.). Philadelphia: Elsevier Saunders. ISBN 978-1-4377-2788-3. стр. 1326.
- ^ Owen LA, Kowalewski AA, Lessnick SL (2008). Wu, Xiaolin, ур. „EWS/FLI mediates transcriptional repression via NKX2.2 during oncogenic transformation in Ewing's sarcoma”. PLoS ONE. 3 (4): e1965. PMC 2291578 . PMID 18414662. doi:10.1371/journal.pone.0001965.
- ^ Sorensen PH, Lessnick SL, Lopez-Terrada D, Liu XF, Triche TJ, Denny CT (фебруар 1994). „A second Ewing's sarcoma translocation, t(21;22), fuses the EWS gene to another ETS-family transcription factor, ERG”. Nat. Genet. 6 (2): 146—51. PMID 8162068. doi:10.1038/ng0294-146.
- ^ Jeon IS, Davis JN, Braun BS, et al. (март 1995). „A variant Ewing's sarcoma translocation (7;22) fuses the EWS gene to the ETS gene ETV1”. Oncogene. 10 (6): 1229—34. PMID 7700648.
- ^ Bernstein M, Kovar H, Paulussen M, et al. (мај 2006). „Ewing sarcoma family of tumours: current management”. Oncologist. 11 (5): 503—19. PMID 16720851. doi:10.1634/theoncologist.11-5-503.
- ^ Iwamoto Y (фебруар 2007). „Diagnosis and treatment of Ewing's sarcoma”. Jpn. J. Clin. Oncol. 37 (2): 79—89. PMID 17272319. doi:10.1093/jjco/hyl142.
- ^ Mutić S, Palta J,Butker E, et al. Quality assurance for computed tomographysimulators and computed tomography simulation process,R.T.C. Taskgroup,2003
- ^ Murat Beyzadeoglu,Gokhan Ozyigit,CyneutEbruli, Basic radiation oncology, Springer Verlag,2010
- ^ Grohar PJ, Woldemichael GM, Griffin LB, et al. Identification of an inhibitor of the EWS-FLI1 oncogenic transcription factor by high-throughput screening. J Natl Cancer Inst. 2011 Jun 22. 103(12):962-78. [Medline]. [Full Text].
- ^ а б в Toretsky A, Jeffrey. „Ewing Sarcoma Differential Diagnoses”. www.emedicine.medscape.com. Приступљено 23. 1. 2020.
- ^ Bacci G, Ferrari S, Mercuri M, et al. Multimodal therapy for the treatment of nonmetastatic Ewing sarcoma of pelvis. Journal of Pediatric Hematology/Oncology. 2003;25(2): pp. 118–124.
- ^ Van Dyk J,Max J, Simulation and imaging for radiation therapy planning, Oxford,2000
- ^ Leavey PJ, Mascarenhas L, Marina N, et al. Prognostic factors for patients with Ewing sarcoma (EWS) at first recurrence following multi-modality therapy: A report from the Children's Oncology Group. Pediatr Blood Cancer. 2008 Sep. 51(3):334-8. [Medline]. [Full Text].
- ^ Cotterill SJ, Ahrens S, Paulussen M, et al. Prognostic factors in Ewing’s tumor of bone: analysis of 975 patients from the European Intergroup Cooperative Ewing’s Sarcoma Study Group. Journal of Clinical Oncology. 2000;18(17):3108–3114.
- ^ McTiernan AM, Cassoni AM, Driver D, Michelagnoli MP, Kilby AM, Whelan JS (2006). „Improving Outcomes After Relapse in Ewing Sarcoma: Analysis of 114 Patients From a Single Institution”. Sarcoma. 2006: 83548. PMC 1698143 . PMID 17496997. doi:10.1155/SRCM/2006/83548.
- ^ а б в г Cotterill SJ, Ahrens S, Paulussen M, Jürgens HF, Voûte PA, Gadner H, et al. Prognostic factors in Ewing's tumor of bone: analysis of 975 patients from the European Intergroup Cooperative Ewing's Sarcoma Study Group. J Clin Oncol. 2000 Sep. 18(17):3108-14. [Medline].
Литература
уреди- Ewing, J: An analysis of radiation therapy in cancer. The Mutter Lecture, Trans. Coll. Physii. Phila., 1928. 3s., 44, 190.
- Ewing, J: The classification and treatment of bone sarcoma. Report Internatl. Conference on Cancer (third), London, 1928. p. 3O5.
- Ewing, J: The causal and formal genesis of cancer. Report Internatl. Conference on Cancer (third), London, 1928. p. 1.
Спољашње везе
уреди| Класификација | |
|---|---|
| Спољашњи ресурси |
| Молимо Вас, обратите пажњу на важно упозорење у вези са темама из области медицине (здравља). |