Целијачна болест
Овај чланак је недовршен. |
Целијачна болест или целијакија је најчешћа хронична гастроентеролошка аутоимуна болест коју карактерише неподношљивост организма на глутен, бјеланчевину пшенице, јечма, ражи и зоби. Обољели морају да се придржавају стриктне дијете, која је скупа, а подразумијева конзумирање намирница без глутена.[1]
| Целијачна болест | |
|---|---|
 | |
| Класификација и спољашњи ресурси | |
| Специјалност | гастроентерологија |
| Patient UK | [https://patient.info/doctor/coeliac-disease-pro coeliac-disease-pro Целијачна болест] |
Епидемиологија
уредиИ поред сазнања да скоро 30% популације носилац гена неопходног за развој целијакије (хаплотип DQ2 i DQ8) само 1% је развило болест и преваленца је у порасту широм света. Разлог ове појаве је непознат. Хипотезе да је појчан садржај глутена у „ модерним житима“ и пораст употребе глутена са временом, су бесмислене, будући да је конзумација жита (свих врста) опала са 99 kg по особи у 1900. години на 60 kg по особи у 2008 години.[2]
Етиопатогенеза
уредиЦелијачна болест је аутоимуно обољење узроковано глијадином и сродним проламинима пшенице, ражи и јечма. Ови протеински фрагменти код генетски предиспонираних особа долазе у контакт са интрацелуларним ензимом ткивна трансглутаминаза, која их деаминира (деаминиран глијадин) што доводи до промене стања и облика протеина. Овако измењени пептиди су лако прихватљиви од HLA DQ2 i DQ8 (молекула изложених на површини ламине проприе познате као антиген презентујуће ћелије) ка CD4 Т ћелијама што резултује каскаднном реакцијом која укључује урођени и стечени имунитет и на крају доводи до оштећења цревних ресица.[2]
Фактори средине
уредиУ факторе средине доприносе повећаној преваленце целијачне болести спадају:
- Начин порођаја (нарочити ризик представља царски рез),
- Ране инфекције — у зависности од узрочника, могу повећати ризик за развој целијачне болести
- Излагање антибиотицима — мада иако се налази сигнификантна корелација са употребом антибиотика, ипак се не налази сигнификантна корелација са употребом антибиотика
- Исхрана у одојачком узрасту
- Сезона рођења
- Социо-економски статус
- Генска предиспозиција — која према недавним студијама показују да време и количина глутена уведеног у исхрану одојчета и релација са природном исхраном немају значајног удела у испољавању целијакије, већ да важну улогу у настанку целијачне болести има генотип високог ризика HLA DQ2 и DQ8. То потврђују и наредне генерације члана породице који болује од целијакије, које су у повећаном ризику за развој ове болести. Тај ризик је код рођака првог степена (родитељ, брат, сестра, дете): 1 од 22 особе. Код рођака другог степена (тетка, стриц, дед, нећакиња, нећак, рођак или полубрат): 1 у 39.
- Хроничне болести — као што је друга аутоимуна стања и болести, која увећавају ризик од целијакије код следећих болести: тип 1 дијабетеса, болести штитасте жлезде, Сјогренов синдром, јувенилни идиопатски артритис, синдром раздражљивих црева, периферну неуропатију, Даунов синдром, Турнер-ов синдром, Вилијаамсов синдром, недостатак ИгА.
- Улога макробиота — се у последње време јако фаворизује као хипотеза усмерена на улогу микробиота у појави болести. Чињеница је да микробиом утиче на развој имунског система и аутоимуних болести; измењена композиција цревне микробиоте описана у пацијената са целијачном болешћу се нормализује после третмана са дијетом без глутена.
Улога проламина
уредиПроламини су протеини за складиштење присутни у семену траве, укључујући житарице, богате глутамином и пролином.[3] Ови протеини су отпорни на протеазе . Проламини такође укључују глутен, секалин и хордеин. Један од елемената глутеина (глутенска фракција растворљива у води и алкохолу) утиче на ентероците, што доводи до смањења непропусности међућелијских спојева и повећања пермеабилности цревне баријере.[4] Ово омогућава макропептидима, укључујући глутен, да уђу у циркулацију, где постају доступни имуном систему и изазивају одговор Т помоћних ћелија.[4][5]
Генетика
уредиВелика већина пацијената са целијакијом има један од два типа HLA-DQ: HLA-DQ2 или DQ8 гена . Овај ген је део рецепторског система МХЦ класе два који представља антиген и омогућава имунолошком систему да разликује себе од страних ћелија. Овај ген се налази на кратком краку хромозома шест, а због повезаности са целијакијом, локус се назива ЦЕЛИАЦ1 .
Постоји седам ХЛА ДК типова (ДК2 и ДК4–ДК9). Више од 99% пацијената са целијакијом има изоформе DQ2 или DQ8 гена.
Рецептори који су производ ових гена, због своје веће способности да везују негативно наелектрисане аминокиселинске остатке, јаче везују глијадин пептиде од других облика овог рецептора. Антиген везан за молекул МХЦ класе два се затим представља као CD4+ у лимфоцитима и активира их.
Већина пацијената са целијакијом носи хаплотипове са два гена ХЛА-ДК2 који се називају DQ2.5 хаплотипови. Овај хаплотип се састоји од два суседна генска алела, DQA1*0501 и DQB1*0201, који кодирају две подјединице, DQ α5 i DQ β2. У већини случајева, изоформа DQ2.5 је кодирана једним од два хромозома 6 наслеђена од родитеља. Већина људи са целијакијом наслеђује једну копију хаплотипа DQ2.5 док неки наслеђују од оба родитеља и изложени су већем ризику од озбиљних компликација. Неки људи наслеђују DQ2.5 од једног родитеља и део хаплотипа (DQB1*02 или DQA1*05) од другог родитеља, што такође повећава ризик.[6]
Само отприлике мање од 1% људи са целијакијом нема ХЛА DQ2 и/или DQ8 гена.[7]
Имунолошки фактори
уредиКључну улогу у покретању абнормалног имунолошког одговора игра абнормална регулација ТЦРαβ од стране CD4+ Т ћелија. ХЛА-ДК2 и ХЛА-ДК8 молекули показују склоност везивању за полипептиде богате негативно наелектрисаним амино киселинама. Деаминација глутена ткивном трансглутаминазом изазива додатно повећање афинитета за глутен, протеин богат пролином и глутамином. Деаминација глутена повећава његов афинитет за ТЦР рецептор 50-100 пута . Глутен се фагоцитира, а затим га представљају АПЦ . Тада се антиген препознаје помоћу специфичних ТЦР рецептора Т помоћних ћелија и луче се проинфламаторни цитокини , укључујући ИФН-α, ТНФ-α , ИЛ-2 и ИЛ-6 . Развија се ефекторска фаза одговора. У овој фази најважнију улогу имају ЦД8+ лимфоцити - цитотоксични Т лимфоцити , који доводе до разарања ентероцита . Интестиналне ресице слузокоже танког црева су оштећене , што резултира смањеном производњом дигестивних ензима и поремећеном секрецијом ткивних хормона произведених у дигестивном тракту. Као последица ових оштећења долази до поремећаја покретљивости црева, поремећаја варења и апсорпције супстанци садржаних у храни, што резуктује појавом недостатака.
Улога ткивне трансглутаминазе и аутоантитела
уредиТкивна трансглутаминаза (тТГ) је ензим укључен у многе биохемијске процесе. Један од његових супстрата је глиадин . Пептид се модификује помоћу тТг помоћу две реакције : деамидације (уклањање амидне групе из остатка глутамина) или трансамидације (три пута чешћа реакција, која укључује унакрсно повезивање остатка глутамина од глијадина до лизина ). Протеини створени као резултат овог процеса постају имуногеничнији. Трансамидација се може одвијати и ван активног места ензима, а истовремено се формира трајна веза између глијадина и тТГ. Ово ствара нове епитопе који покрећу имуни одговор са формирањем антитела против тТГ.
У серуму пацијената, поред антитела против ткивне трансглутаминазе (тТГ), детектују се и антиендомизијска антитела (ЕмА), антиретикулинска антитела ( АрА), антиглијадинска антитела АгА) и антитела против деаминираних глијадин пептида (ДГП). Антиендомизијска антитела се сматрају врстом антитела против ткивне трансглутаминазе која се налази на површини ћелије. У дијагностици болести користе се антитела, класа ИгА укључује антиендомизијска антитела (ЕмА), анти-ткивна трансглутаминазу (тТГ) и антитела против деаминираних глијадин пептида (ДГП) .
Пријављени су случајеви сероконверзије теста који открива антитела против трансглутаминазе ткива код деце која су имала ротавирусну дијареју.
Клиничка слика
уредиКлиничка слика се код неких појединца развија рано у животу, док се други осећају здраво до дубоке старости, јер такве особе са целијачном болести немају никаквих знакова или симптоме.
Због полиморфности манифестних промена клиничка презентација целијакије може бити типична, атипична,тиха и потенцијална.
| Облици | Карактеристике |
|---|---|
| Типична | Подразумева присутне гастроинтестиналне симптом. Типична целијакија се караткреише позитивним тестом серологије, са симптомима или без њих и без видљиве интестиналне инфламације на биопсији. Иако су типичне презентације биле много учесталије напочетку и на средини 20. века, после 80-их година 20. века се бележи заокрет од класичних гастроинтестиналних симптома ка више случајева са атипичном и асимптоматском презентацијом, с тим да су најређе оне са слабијим напредовањем у телесној маси. |
| Атипична | Има превасходно екстраинтестиналне манифестације. |
| Тиха целијакија | Описује асимптоматске пацијенте са позитивним тестом серологије и интестиналном инфламацијом на биопсији |
| Потенцијална форма | Укључује пацијенте са позитивним тестом серологије, са симптомима или без њих и без видљиве интестиналне инфламације на биопсији. |
Најчешћи клинички знаци и симптоми
уредиНа основу бројних истраживања спроведеним у први деценијама 21. века утврђено је да постоји више од 300 симптома целијакије, који се могу разликовати од особе до особе, и зато се због велике бројности могу разврстати на следећи начин:
| Органиски системи | Знаци и симптоми |
|---|---|
| Општи |
|
| Централни нервни систем |
|
| Кожа и слузокожа |
|
| Гастроинтестинални систем |
|
| Репродуктивни систем |
|
| Мускулоскелетни и зубни систем |
|
Дијагноза
уредиУ дијагностици су најважнији фактори одређивање карактеристичних антитела, хистопатолошки преглед промена у биопсијама дуоденалне слузокоже и откривање ХЛА ДК2 и/или ДК8 хаплотипова.
Серолошки тестови
уредиУ дијагнози целијакије, антиендомизијална антитела (ЕмА), анти-ткивна трансглутаминаза (тТГ) и антитела против деаминираних глијадинских пептида (ДГП) се мере у ИгА класи , након искључивања недостатка ИгА , дакле укупан ИгА концентрацију треба проценити истовремено . Ако је ниво ИгА <0,2 г/Л, антитела се мере у ИгГ класи . Антиглиадин антитела (АГА) се сматрају неспецифичним .
Тумачење резултата нивоа треба да узме у обзир укупан ниво ИгА у серуму , врсту конзумираног глутена, начин конзумирања глутена, старост пацијента и утицај имуносупресивних лекова . Негативан резултат није поуздан када је глутен повучен из исхране на дужи период (неколико недеља до годину дана) или је изложеност била кратка .
тТГА тест је препоручени скрининг тест јер га карактерише веома висока осетљивост (преко 90%) и специфичност (скоро 100%). Серолошки тестови су вредни у скрининг тестовима, али дијагноза се не може поставити само на основу њиховог позитивног резултата, међутим, у случају негативног резултата, целијакија се може искључити .
Серолошке маркере целијакије је први пут у свету описао професор Тадеуш Чорзелски са Одељења за дерматологију Медицинског универзитета у Варшави .
Генетско тестирање
уредиУ дијагнози целијакије препоручује се мерење алела ХЛА-ДК2 и/или ДК8 . Код пацијената са целијакијом, учесталост ХЛА-ДК2 се процењује на 90–95% и ХЛА-ДК8 на 5–10%, док у општој популацији ДК2 на 25–30% и ХЛА-ДК8 на 5–15% . Само отприлике мање од 1% људи са целијакијом нема ХЛА ДК2 и/или ДК8 . Одсуство антигена ХЛА-ДК2 или ХЛА-ДК8 практично искључује болест .
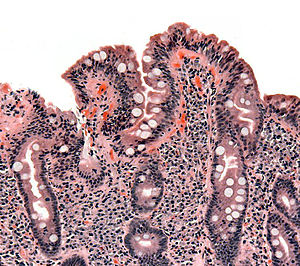
Хистопатолошки преглед
уредиХистопатолошки преглед узорка слузокоже танког црева је пресудан у дијагнози целијакије, која се не може дијагностиковати без биопсије танког црева. Узорци се узимају током ендоскопског прегледа дванаестопалачног црева (гастродуоденоскопија) помоћу клешта или сукцијске биопсије коришћењем Кросбијеве капсуле уметнуте током ендоскопије . Капсула се такође може прогутати, иако је за то потребна радиолошка контрола локације капсуле. Потребно је узети узорке из луковице дуоденума (>1 место) и из даљих делова дуоденума (>4 места) . Слузокожу треба сакупљати испод Ватерове ампуле . Узорак је оцењен према Маршовој класификацији. Препоруке претпостављају лезије Марсх типа 2 и 3 као патологију карактеристичну за целијакију .
Ендоскопија
уредиЕндоскопским прегледом дванаестопалачног црева уочава се смањење броја, спљоштење или нестанак дуоденалних набора, браздастих ивица, мозаичне структуре површине слузокоже и провидних мукозних судова . Приликом прегледа узимају се узорци за хистопатолошки преглед.
Лабораторијски тестови
уреди- анемија због недостатка гвожђа: смањена концентрација хемоглобина (Хб), смањен МЦВ , МЦХ ,
- снижени нивои у крви: гвожђа, фолне киселине , калцијума , витамина Д и К ,
- хипоалбуминемија .
Терапија
уредиЈедина метода лечења је дијета без глутена , која подразумева потпуно и непрекидно избацивање пшенице, ражи и јечма из исхране. Дијету без глутена треба препоручити сваком пацијенту са симптоматском целијакијом са лезијама у танком цреву и асимптоматским пацијентима са лезијама танког црева. Лекар треба да размотри лечење пацијената са позитивним антителима и нормалном биопсијом дуоденума. Типично, дневни унос глутена >100 мг/дан доводи до развоја симптома. Безбедан садржај глутена у исхрани је <35 мг/дан, али неки пацијенти не толеришу унос од 10 мг/дан. Пиринач и кукуруз су дозвољени производи. Овас је безбедан за 95% пацијената са целијакијом ако није контаминиран другим забрањеним житарицама. На почетку лечења користи се исхрана са мало масти и лактозе. Дијета без глутена садржи премало влакана , што може бити повезано са повећаним ризиком од затвора. Пацијенти треба да допуне своју исхрану пиринчем од целог зрна, кукурузом, кромпиром и воћем. Дијету без глутена такође треба допунити витаминима Б, витамином Д, калцијумом, гвожђем, цинком и магнезијумом.
Током терапије неопходно је уочити и рано открити недостатке хранљивих материја, микроелемената, електролита, витамина Д и К , гвожђа и, ако се открију, исправити недостатке.
Такође је неопходно посматрати скелетни систем код превремене остеопорозе.
Један од проблема је и повећана учесталост гојазности која је резултат употребе безглутенске дијете.
У бјављене студијама покушалом се са смањем токсичности глутена. Према једној од њих, орална конзумација бактеријског ензима, пролилендопептидазе, смањила је његову токсичност, што би се у будућности могло користити у терапији.
Нови третмани у истраживању
уредиУпркос вишесмерном истраживању нових метода лечења, строга дијета без глутена и даље остаје основна терапија. Жељени ефекат нових терапија могли би би да омогуће конзумацију малих количина глутена, што би значајно побољшало квалитет живота пацијената.
| Терпија | Резултати |
|---|---|
| Пролилендопептидаза | Ендопротеолитички ензим микроорганизама и биљака. Ензим цепа глутен богат пролином на мање пептиде који се могу варити цревним ензимима. Утврђено је смањење тежине синдрома малапсорпције након употребе овог лека. Међутим, ензим има ограничену клиничку употребу због потребне 3-часовне пре-инкубације ензима са храном. |
| АЛВ003 | Мешавина две глутаминазе, ензима који могу да разграђују глутен. У рандомизованом испитивању, АЛВ003 није ублажио симптоме, али може довести до смањеног оштећења цревне слузокоже у поређењу са плацебом . |
| Лактобацилус | Бактерија која може да лизира глутен као резултат ферментације, смањујући његову имуногеност. |
| ВСЛ | Пробиотик који садржи бактерије Bifidobacterium, Lactobacillus и Streptococcus salivarius. Може се користити за претходну обраду брашна у прехрамбеној индустрији за добијање производа без глутена. |
| Ларазотид | Синтетички хексапептид изведен из токсина Vibrio cholerae. Користи се за затварање уских спојева између епителних ћелија које су олабављене током патолошког процеса, чиме се инхибира апсорпција глијадина. Ова стратегија лечења би морала да се комбинује са другим лековима . Није примећена значајна разлика у поређењу са плацебом. |
| Синтетички полимер ХЕМА-цо-СС | Који формира комплексе са глиадином, смањујући његов утицај на цревни епител. Нарушавањем ефикасности дигестивних ензима на глијадин, смањује се формирање више имуногених пептида. Потребна су даља истраживања пре него што се спроведу клиничка испитивања. |
| Орално анти-глиадин антитело | Облик пасивне имунотерапије, може бити алтернатива за неутрализацију глијадина у гастроинтестиналном тракту и спречавање његове апсорпције. Користе се антитела жуманца, која се релативно лако и економично могу добити из жуманца. Мишеви храњени антителима показали су минималну апсорпцију глутена. |
| Селективно блокирање ткивне трансглутаминазе | То је обећавајући потенцијални метод инхибиције инфламаторног процеса изазваног конзумацијом глутена. |
| Имунотерапија | Абнормални имуни одговор на глутен игра значајну улогу у патогенези целијакије. Ово је теоријска основа за креирање имунотерапије која има за циљ изазивање имунолошке толеранције на глутен. |
| Модификација имуног одговора | Постулати модификовање одговора блокирањем презентације антигена (ХЛА блокатор), блокирањем интерлеукина (ИЛ-10, ИЛ-15) и блокирањем НКГ2Д рецептора . |
Превенција целијакије
уредиРезултати многих студија доказују да постепено увођење глутена током дојења смањује ризик од развоја целијакије. Увођење глутена у исхрану у прва 3 месеца живота повећава ризик од развоја целијакије пет пута у поређењу са увођењем глутена у узрасту од 4-6 месеци. Такође треба избегавати увођење глутена после 7 месеци живота.
Према новим режимима исхране одојчади, глутен треба уводити у исхрану постепено у малим количинама у 5-6. месецу живота у случају дојења, а у случају храњења адаптираним млеком најраније у 5 месецу, а најкасније до крај 6. месеца живота. Доза излагања треба да буде 2-3 грама (нпр. гриза на 100 мл оброка. У наредна 2 месеца доза излагања повећава се на 4-6 грама.
Друштвене последице
уредиЦелијакија, као и други поремећаји повезани са глутеном, може отежати испуњавање одређених верских обичаја, као што је примање причешћа, које, према доктрини Католичке цркве, морају бити направљене од пшенице. За вернике који болују од целијакије црква све више обезбеђује посебне хостије са мало глутена, или је дозвољено причешћивање само вином.
Извори
уреди- ^ Radlović N, Leković Z, Radlović V; et al. (2017). „Alergija na hranu u dečjoj dobi – klinički aspekt”. Biomedicinska istraživanja. 8 (2): 208—14. doi:10.7251/bii1702208r.
- ^ а б Jericho, H.; Assiri, A.; Guandalini, S. (2017). „Celiac disease and wheat intolerance syndrome: A critical update and reappraisal”. J Pediatr Gastroenterol Nutr. 64 (1): 15—21. PMID 27322560. doi:10.1097/MPG.0000000000001312..
- ^ „prolaminy, Encyklopedia PWN: źródło wiarygodnej i rzetelnej wiedzy”. encyklopedia.pwn.pl (на језику: пољски). Приступљено 2024-07-14.
- ^ а б Lammers, Karen M.; Lu, Ruliang; Brownley, Julie; Lu, Bao; Gerard, Craig; Thomas, Karen; Rallabhandi, Prasad; Shea-Donohue, Terez; Tamiz, Amir (2008). „Gliadin Induces an Increase in Intestinal Permeability and Zonulin Release by Binding to the Chemokine Receptor CXCR3”. Gastroenterology (на језику: енглески). 135 (1): 194—204.e3. PMC 2653457 . PMID 18485912. doi:10.1053/j.gastro.2008.03.023.
- ^ Gujral, Naiyana (2012). „Celiac disease: Prevalence, diagnosis, pathogenesis and treatment”. World Journal of Gastroenterology (на језику: енглески). 18 (42): 6036. ISSN 1007-9327. PMID 23155333. doi:10.3748/wjg.v18.i42.6036 .
- ^ Jores, Rita-Désirée; Frau, Fulvia; Cucca, Francesco; Grazia Clemente, Maria; Orrù, Sandra; Rais, Marco; De Virgiliis, Stefano; Congia, Mauro (2007). „HLA-DQB1*0201 homozygosis predisposes to severe intestinal damage in celiac disease”. Scandinavian Journal of Gastroenterology. 42 (1): 48—53. ISSN 0036-5521. PMID 17190762. doi:10.1080/00365520600789859.
- ^ Anderson, Robert P; Henry, Margaret J; Taylor, Roberta; Duncan, Emma L; Danoy, Patrick; Costa, Marylia J; Addison, Kathryn; Tye-Din, Jason A; Kotowicz, Mark A (2013-08-28). „A novel serogenetic approach determines the community prevalence of celiac disease and informs improved diagnostic pathways”. BMC Medicine. 11: 188. ISSN 1741-7015. PMC 3765645 . PMID 23981538. doi:10.1186/1741-7015-11-188 .
Спољашње везе
уреди| Класификација | |
|---|---|
| Спољашњи ресурси |
- Званична презентација Удружења Србије за целијакију, Приступљено 18. априла 2011.
- Целијакија – одговори на најчешћа питања, Биошпајз, Приступљено 18. априла 2011.
| Молимо Вас, обратите пажњу на важно упозорење у вези са темама из области медицине (здравља). |