Supstitucija (hemija)
U supstitucionim reakcijama, funkcionalna grupa jednog hemijskog jedinjenja se zamenjuje drugom grupom.[1][2] U organskoj hemiji, reakcije elektrofilne i nukleofilne supstitucije imaju primarni značaj. Reakcije organske supstitucije se klasifikuju u nekoliko glavnih tipova organskih reakcija u zavisnosti od toga da li je reagens elektrofil ili nukleofil, da li je reakcioni intermedijar karbokatjon, karbanjon ili slobodni radikal, ili da li je supstrat alifatičan ili aromatičan. Detaljno razumevanje tipa reakcije pomaže u predviđanju produkta reakcije. To je takođe korisno za optimizaciju reakcije u pogledu promenljivih, kao što su temperatura i izvor rastvarača.
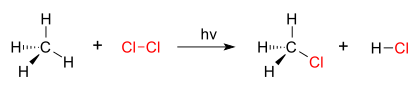
Dobar primer reakcije supstitucije je fotohemijska hlorinacija metana kojom se formira metil hlorid. Kada se hlorni gas (Cl2) ozrači, neki od molekula se cepaju na dva radikala hlora (Cl•), čiji su slobodni elektroni jako nukleofilni. Jedan od njih prekida kovalentnu vezu C–H u CH4 i grabi atom vodonika da bi formirao električni neutralni HCl. Drugi radikal reformiše kovalentnu vezu sa CH3• da bi formirao CH3Cl (metil hlorid).
| Hlorinacija metana hlorom |
|---|
Nukleofilna supstitucija
уредиNukleofilna supstitucija se odvija kad je reagens nukleofil (atom ili molekul sa slobodnim elektronima).[1][2] Nukleofil reaguje sa alifatičnim supstratom u reakciji nukleofilne alifatične supstitucija.[3][4] Ta supstitucija se može odvijati putem dva različita mehanizma: unimolekularna nukleofilna supstitucija (SN1) i bimolekularna nukleofilna supstitucija (SN2). SN1 mehanizam ima dva stupnja. U prvom stupnju, odlazeća grupa se udalji, čime se formira karbokatjon. U drugom stupnju, nukleofilni reagens napada karbokatjon i formira sigma vezu. Ovaj mehanizam može da proizvede bilo inverziju ili zadržavanje konfiguracije. SN2 reakcija ima samo jedan stupanj. Napad reagensa i uklanjanje odlazeće grupe se odvijaju istovremeno. Ovaj mehanizam uvek dovodi do inverzije konfiguracije.[5]
Kad je supstrat aromatično jedinjenje reakcioni tip je nukleofilna aromatična supstitucija. Derivati karboksilnih kiselina reaguju sa nukleofilima u nukleofilnoj acilnoj supstituciji.[6] Ova vrsta reakcije može biti korisna u pripremi jedinjenja.
Najopštiji oblik za reakciju može se dati kao
- Nuc: + R-LG → R-Nuc + LG:
gde R-LG označava supstrat. Elektronski par (:) iz nukleofila (Nuc:) napada supstrat (R-LG), formirajući novu kovalentnu vezu Nuc-R-LG. Prethodno stanje naelektrisanja se vraća kada odlazeća grupa (LG) ode sa elektronskim parom. Glavni proizvod u ovom slučaju je R-Nuc. U takvim reakcijama, nukleofil je obično električno neutralan ili negativno naelektrisan, dok je supstrat obično neutralan ili pozitivno naelektrisan.
Primer nukleofilne supstitucije je hidroliza alkil bromida, R-Br, pod baznim uslovima, gde je napadački nukleofil baza OH−, a odlazeća grupa je Br−:
- R-Br + OH− → R-OH + Br−
Reakcije nukleofilne supstitucije su uobičajene u organskoj hemiji i mogu se široko kategorisati kao da se odvijaju na ugljeniku zasićenog alifatičnog jedinjenja ugljenika ili (ređe) u aromatičnom ili drugom nezasićenom ugljenikovom centru.[1]
Mehanizmi
уредиNukleofilne supstitucije na alifatičnim ugljeničnim centrima mogu se odvijati pomoću dva različita mehanizma, unimolekularne nukleofilne supstitucije (SN1) i bimolekularne nukleofilne supstitucije (SN2).
Mehanizam SN1 ima dva koraka. U prvom koraku, odlazeća grupa odlazi, formirajući karbokatjon C+. U drugom koraku, nukleofilni reagens (Nuc:) se vezuje za karbokation i formira kovalentnu sigma vezu. Ako supstrat ima hiralni ugljenik, ovaj mehanizam može rezultirati ili inverzijom stereohemije ili zadržavanjem konfiguracije. Obično se i jedno i drugo javlja bez preferencije. Rezultat je racemizacija.
Mehanizam SN2 ima samo jedan korak. Napad reagensa i izbacivanje grupe koja odlazi se dešavaju istovremeno. Ovaj mehanizam uvek rezultira inverzijom konfiguracije. Ako je supstrat koji je pod nukleofilnim napadom hiralan, reakcija će stoga dovesti do inverzije njegove stereohemije, nazvane Valdenova inverzija.
SN2 napad se može desiti ako napad sa zadnji strane nije sterički ometan supstituentima na supstratu. Stoga se ovaj mehanizam obično javlja u neometanom primarnom centru ugljenika. Ako postoji sterično zakrčenje na supstratu u blizini odlazeće grupe, kao što je u tercijarnom centru ugljenika, supstitucija će uključivati SN1 a ne SN2 mehanizam; SN1 bi takođe bio verovatniji u ovom slučaju, jer bi se mogao formirati dovoljno stabilan karbokacioni posrednik.
Elektrofilna supstitucija
уредиElektrofili učestvuju u reakcijama elektrofilne supstitucije, a posebno u elektrofilnim aromatičnim supstitucijama.[7][8]
| Elektrofilna aromatična supstitucija |
|---|
Elektrofilne reakcije sa drugim nezasićenim jedinjenjima, osim arena, generalno dovode do elektrofilne adicije umesto supstitucije.
Radikalna zamena
уредиReakcija radikalne supstitucije uključuje radikale.[1] Primer je Hansdikerova reakcija.[9][10][11][12][13]
Organometalna supstitucija
уредиReakcije kuplovanja su klasa reakcija katalizovanih metalom koje uključuju organometalno jedinjenje RM i organski halid R′X koji zajedno reaguju da bi formirali jedinjenje tipa R-R′ sa formiranjem nove veze ugljenik-ugljenik. Primeri uključuju Hekovu reakciju, Ulmanovu reakciju i Vurc-Fitigovu reakciju. Postoje mnoge varijacije.[14]
Supstituisana jedinjenja
уредиSupstituisana jedinjenja su hemijska jedinjenja u kojima je jedan ili više atoma vodonika u strukturi jezgra zamenjeno funkcionalnom grupom kao što je alkil, hidroksi ili halogen, ili sa većim supstituentskim grupama.
Na primer, benzen je jednostavan aromatični prsten. Benzeni koji su podvrgnuti supstituciji su heterogena grupa hemikalija sa širokim spektrom upotrebe i svojstava:
| Primeri supstituisanih jedinjenja benzena | ||
| jedinjenje | opšta formula | opšta struktura |
| Benzen | C6H6 | |
| Toluen | C6H5-CH3 | |
| o-Ksilen | C6H4(-CH3)2 | |
| Mesitilen | C6H3(-CH3)3 | |
| Fenol | C6H5-OH | |
Vidi još
уредиReference
уреди- ^ а б в г March, Jerry (1985), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (3rd изд.), New York: Wiley, ISBN 0-471-85472-7
- ^ а б Imyanitov, Naum S. (1993). „Is This Reaction a Substitution, Oxidation-Reduction, or Transfer?”. J. Chem. Educ. 70 (1): 14—16. Bibcode:1993JChEd..70...14I. doi:10.1021/ed070p14.
- ^ Neumann CN, Hooker JM, Ritter T (јун 2016). „Concerted nucleophilic aromatic substitution with (19)F(-) and (18)F(-)”. Nature. 534 (7607): 369—73. PMC 4911285 . PMID 27281221. doi:10.1038/nature17667.
- ^ Rohrbach S, Smith AJ, Pang JH, Poole DL, Tuttle T, Chiba S, Murphy JA (новембар 2019). „Concerted Nucleophilic Aromatic Substitution Reactions”. Angewandte Chemie. 58 (46): 16368—16388. PMC 6899550 . PMID 30990931. doi:10.1002/anie.201902216.
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ Goldstein SW, Bill A, Dhuguru J, Ghoneim O (септембар 2017). „Nucleophilic Aromatic Substitution Addition and Identification of an Amine.”. Journal of Chemical Education. 94 (9): 1388—90. Bibcode:2017JChEd..94.1388G. doi:10.1021/acs.jchemed.6b00680.
- ^ Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th изд.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
- ^ Gawley, Robert E. (1999-06-04). „A proposal for (slight) modification of the Hughes–Ingold mechanistic descriptors for substitution reactions”. Tetrahedron Letters. 40 (23): 4297—4300. ISSN 0040-4039. doi:10.1016/S0040-4039(99)00780-7.
- ^ Li, J. J. (2014-01-30). „Hunsdiecker–Borodin Reaction”. Name Reactions: A Collection of Detailed Mechanisms and Synthetic Applications (5th изд.). Springer Science & Business Media. стр. 327—328. ISBN 9783319039794.
- ^ Borodin, A. (1861). „Ueber Bromvaleriansäure und Brombuttersäure” [About bromovaleric acid and bromobutyric acid]. Annalen der Chemie und Pharmacie (на језику: German). 119: 121—123. doi:10.1002/jlac.18611190113.
- ^ Borodin, A. (1861). „Ueber de Monobrombaldriansäure und Monobrombuttersäure” [About the monobromovaleric acid and monobromobutyric acid]. Zeitschrift für Chemie und Pharmacie (на језику: German). 4: 5—7.
- ^ Simonini, A. (1892). „Über den Abbau der fetten Säuren zu kohlenstoffärmeren Alkoholen” [About the breakdown of fatty acids to lower carbon alcohols]. Monatshefte für Chemie und verwandte Teile anderer Wissenschaften (на језику: German). 13 (1): 320—325. S2CID 197766447. doi:10.1007/BF01523646.
- ^ Simonini, A. (1893). „Über den Abbau der fetten Säuren zu kohlenstoffärmeren Alkoholen” [About the breakdown of fatty acids to lower carbon alcohols]. Monatshefte für Chemie und verwandte Teile anderer Wissenschaften (на језику: German). 14 (1): 81—92. S2CID 104367588. doi:10.1007/BF01517859.
- ^ Elschenbroich, C.; Salzer, A. (1992). Organometallics: A Concise Introduction (2nd изд.). Weinheim: Wiley-VCH. ISBN 3-527-28165-7.
Literatura
уреди- R. A. Rossi, R. H. de Rossi, Aromatic Substitution by the SRN1 Mechanism, ACS Monograph Series No. 178, American Chemical Society, 1983. ISBN 0-8412-0648-1
- L. G. Wade, Organic Chemistry, 5th ed., Prentice Hall, Upper Saddle River, New Jersey, 2003.
- S. R. Hartshorn, Aliphatic Nucleophilic Substitution, Cambridge University Press, London, 1973. ISBN 0-521-09801-7
- Introducing Aliphatic Substitution with a Discovery Experiment Using Competing Electrophiles Timothy P. Curran, Amelia J. Mostovoy, Margaret E. Curran, and Clara Berger Journal of Chemical Education 2016 93 (4), 757-761 . doi:10.1021/acs.jchemed.5b00394. Недостаје или је празан параметар
|title=(помоћ) - N.S.Imyanitov. Electrophilic Bimolecular Substitution as an Alternative to Nucleophilic Monomolecular Substitution in Inorganic and Organic Chemistry. J. Gen. Chem. USSR (Engl. Transl.) 1990; 60 (3); 417-419.
- Unimolecular Nucleophilic Substitution does not Exist / N.S.Imyanitov. SciTecLibrary
- Lenoir, D.; Chiappe, C. (2003). „What is the Nature of the First-Formed Intermediates in the Electrophilic Halogenation of Alkenes, Alkynes, and Allenes?”. Chem. Eur. J. 9 (5): 1036—1044. PMID 12596140. doi:10.1002/chem.200390097.
- Brown, R. S. (1997). „Investigation of the Early Steps in Electrophilic Bromination through the Study of the Reaction with Sterically Encumbered Olefins”. Acc. Chem. Res. 30 (3): 131—137. doi:10.1021/ar960088e.
- Vollhardt, K. Peter C.; Schore, Neil Eric (јануар 2014). Organic chemistry : structure and function (7th изд.). New York, NY. ISBN 978-1-4641-2027-5. OCLC 866584251.
- Fahey, Robert C.; Lee, Do-Jae. (април 1968). „Polar additions to olefins and acetylenes. V. Bimolecular and termolecular mechanisms in the hydrochlorination of acetylenes”. Journal of the American Chemical Society (на језику: енглески). 90 (8): 2124—2131. ISSN 0002-7863. doi:10.1021/ja01010a034.
- Carroll, Felix A. (2010). Perspectives on structure and mechanism in organic chemistry (2nd изд.). Hoboken, N.J.: John Wiley. ISBN 9780470276105. OCLC 286483846.
- Mootz, Dietrich; Deeg, Axel (јул 1992). „2-Butyne and hydrogen chloride cocrystallized: solid-state geometry of Cl-H.cntdot..cntdot..cntdot..pi. hydrogen bonding to the carbon-carbon triple bond”. Journal of the American Chemical Society (на језику: енглески). 114 (14): 5887—5888. ISSN 0002-7863. doi:10.1021/ja00040a077.
- Lowry, Thomas H. (1987). Mechanism and theory in organic chemistry . Richardson, Kathleen Schueller. (3rd изд.). New York: Harper & Row. ISBN 978-0060440848. OCLC 14214254.
- Wang, Z.; Tu, Y.; Frohn, M.; Zhang, J.; Shi, Y. (1997). „An Efficient Catalytic Asymmetric Epoxidation Method”. J. Am. Chem. Soc. 119 (46): 11224—11235. doi:10.1021/ja972272g.
- Davis, F. A.; Kumar, A.; Chen, B. C. (1991). „Chemistry of oxaziridines. 16. A short, highly enantioselective synthesis of the AB-ring segments of γ-rhodomycionone and α-citromycinone using (+)-[(8,8-dimethoxycamphoryl)sulfonyl]oxaziridine”. J. Org. Chem. 56 (3): 1143—1145. doi:10.1021/jo00003a042.
- Uehlin, L.; Wirth, T. (2001). „Novel Polymer-Bound Chiral Selenium Electrophiles”. Org. Lett. 3 (18): 2931—2933. PMID 11529793. doi:10.1021/ol0164435.
- Tjosaas F, Fiksdahl A (фебруар 2006). „A simple synthetic route to methyl 3-fluoropyridine-4-carboxylate by nucleophilic aromatic substitution”. Molecules (Basel, Switzerland). 11 (2): 130—3. PMC 6148553 . PMID 17962783. doi:10.3390/11020130 .
- Bella M, Kobbelgaard S, Jørgensen KA (март 2005). „Organocatalytic regio- and asymmetric C-selective S(N)Ar reactions-stereoselective synthesis of optically active spiro-pyrrolidone-3,3'-oxoindoles”. Journal of the American Chemical Society. 127 (11): 3670—1. PMID 15771481. doi:10.1021/ja050200g.
Спољашње везе
уреди- „Nucleophiles and Electrophiles”. butane.chem.uiuc.edu. Архивирано из оригинала 01. 08. 2020. г. Приступљено 2020-09-21.
- „Electrophile | chemistry”. Encyclopedia Britannica (на језику: енглески). Приступљено 2020-09-21.
- Aromatic Substitution Reactions – MSU