Slobodni elektronski par
U hemiji, slobodni par je par valentnih elektrona bez hemijske veze, To su elektroni koje atom ne deli sa drugim atomima. Oni su locirani na spoljašnjem elektronskom sloju atoma, tako da su slobodni parovi podskup molekulskih valentnih elektrona. Oni se mogu identifikovati pregledom spoljašnjeg energijskog nivoa atoma. Slobodni elektronski parovi se sastoje od parova elektrona za razliku od pojedinačnih elektrona, koji se javljaju u nepopunjenim atomskim orbitalama. Ukupni broj valentnih elektrona jedinjenja je zbir broja slobodnih parova i broja vezujućih elektrona.[1][2]
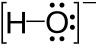
Primeri
уредиJedan slobodni pare se može naći na atomima azotnih grupa kao što je azot u amonijaku, a dva slobodna para se mogu naći na atomima u halkogenih grupa kao što je kiseonik u vodi. Halogeni mogu da imaju tri slobodna para, npr. u hlorovodoničnoj kiselini.
U jednostavnoj elektronskoj teoriji valence atom kiseonika u vodi je sp3 hibridizovan sa slobodnim parovima u sp3 orbitalama. Ugao H–O–H veze je 104.5°, što je manje od 109° za pravilni tetraedarski ugao. To se može objasniti repulzivnim interakcijama između slobodnih parova.[3][4][5]
Vidi još
уредиReference
уреди- ^ Parkes, G.D. & Phil, D. (1973). Melorova moderna neorganska hemija. Beograd: Naučna knjiga.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. изд.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ Organic Chemistry Marye Anne Fox , James K. Whitesell 2nd Edition 2001
- ^ McMurry John E. (1992). Fundamentals of Organic Chemistry (3rd изд.). Belmont: Wadsworth. ISBN 0-534-16218-5.
- ^ Concise Inorganic Chemistry J.D. Lee 4th Edition 1991