Makula denza
Makula denza ili gusta mrlja jeste područje blisko zbijenih specijalizovanih ćelija koje oblažu zid distalnog tubula, na mestu gde se uzlazne grane Henleove petlje susreću sa distalnom izuvijanom cevi. To je zadebljanje u kome distaknu tubul dodiruje glomerul.[1]
| Makula denza | |
|---|---|
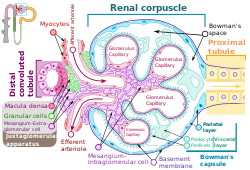 Bubrežno telađce na kome je pokazana makula denza. | |
| Identifikatori | |
| FMA | 86333 |
| Anatomska terminologija | |
Kao takvo, povećanje koncentracije natrijum hlorida bi dovelo do vazokonstrikcije aferentnih arteriola i smanjene parakrine stimulacije jukstaglomerularnih ćelija. Ovo ukazuje na povratnu petlju macula densa, gde funkcionišu kompenzatorni mehanizmi, kako bi se GFR vratio u normalu.
Oslobađanje renina je suštinska komponenta sistema renin-angiotenzin-aldosteron ("RAAS"), koji reguliše krvni pritisak i zapreminu.
Fiziologija
urediĆelije makula denze su osetljive na koncentraciju natrijum hlorida u distalnom uvijenom tubulu Henleove petnje. Smanjenje koncentracije natrijum hlorida pokreće signal iz makula denze koji ima dva efekta:[2]
- Smanjuje otpor protoku krvi u uzlaznim (aferentnim) arteriolama, što podiže glomerularni hidrostatički pritisak i pomaže da se brzina glomerularne filtracije (BGFR) vrati u normalu.
- Povećava oslobađanje renina iz jukstaglomerularnih ćelija uzlaznih (aferentnih) i silaznih (eferentnih) arteriola, koje su glavna mesta skladištenja renina.[1]
U ovi uslovima, povećanje koncentracije natrijum hlorida bi dovelo do vazokonstrikcije aferentnih arteriola i smanjene parakrine stimulacije jukstaglomerularnih ćelija. Ovo pokazuje povratnu spregu makule denza, u kojoj kompenzatorni mehanizmi deluju kako bi vratili BGFR u normalu.
Oslobađanje renina je suštinska komponenta renin-angiotenzin-aldosteron sistema (RAAS), koji reguliše krvni pritisak i zapreminu.[3]
Histologija
uredi1 − Glomerul
2 − Distalna izuvijena cev
Ćelije makule denze su veće i imaju istaknutija jezgra od okolnih ćelija distalnog pravog tubula (debela uzlazna grana).
Ćelije makule denze distalnog uvijenog tubula su manje od uobičajenih kuboidnih ćelija tubula i prilično su zbijene jedna uz drugu. Mogu se prepoznati po bliskom pakovanju i tamnom obojenom jezgru. Naime neposredna blizina i istaknutost jezgara uzrokuje da ovaj segment zida distalnog tubula, u mikroskopskim preparatima, izgleda tamniji i gušći, pa otuda i naziv makula denza.[4]
Čini se da ove ćelije imaju drugačiji morfološki polaritet od susednih kuboidnih ćelija (Goldžijev aparat leži između jezgara i baza ćelija). Ispod ćelija makule denze, bazalna lamina je tanka sa produžecima ćelija koje prolaze kroz nju.
Smatra se da su ćelije makule denze senzorne ćelije koje reaguju na koncentraciju natrijuma u tečnosti unutar distalnog tubula i, možda, na brzinu protoka tečnosti pored njih. Povećanje koncentracije natrijuma u tubularnoj tečnosti dovodi do smanjenja proizvodnje renina ekstraglomerularnim mezangijalnim ćelijama i jukstaglomerularnim ćelijama.
Funkcija
urediĆelije makule denze osećaju promene u nivoima natrijum hlorida i iniciraju autoregulatorni odgovor za povećanje ili smanjenje reapsorpcije jona i vode u krv (po potrebi) kako bi promenili zapreminu krvi i vratili krvni pritisak u normalu.
Smanjenje prečnika aferentne arteriole uzrokuje smanjenje brzine glomerularne filtracije, što rezultuje smanjenom koncentracijom jona natrijuma i hlorida u filtratu i/ili smanjenom brzinom protoka filtrata. Smanjenje krvnog pritiska znači smanjen venski pritisak i, samim tim, smanjen peritubularni i kapilarni pritisak. Ovo rezultuje nižim kapilarnim hidrostatskim pritiskom, što uzrokuje povećanu apsorpciju natrijum jona u vaza rekta proksimalnog tubula.
Dakle, smanjenje krvnog pritiska dovodi do manjeg prisustva natrijum hlorida u distalnom tubulu, gde se nalazi makula denza. On oseća ovaj pad koncentracije soli i reaguje preko dva mehanizma, od kojih oba posreduju u oslobađanju prostaglandina.[5]
Prvo, prostaglandini prvenstveno vazodilatiraju uzlaznu bubrežnu arteriolu, smanjujući otpor aferentnih arteriola i na taj način poništavaju smanjenje glomerularnog hidrostatskog pritiska uzrokovano padom krvnog pritiska.
Drugo, prostaglandin aktivira osetljive specijalizovane ćelije glatkih mišića jukstaglomerularnih ćelija uzlaznih arteriola (JG ćelije) da otpuste renin u krvotok. JG ćelije takođe mogu da oslobađaju renin nezavisno od macula densa.
Postoje baroreceptori osetljivi na istezanje koji oblažu arteriole i oslobađaju renin ako se u arteriolama otkrije pad krvnog pritiska (ili smanjeno istezanje arteriola zbog manjeg protoka krvi). Kako JG-ćelije sadrže beta-1 adrenergički receptor, aktivacija simpatičkog nervnog sistema dalje stimuliša oslobađanje renina.
Tako nastao pad krvnog pritiska dovodi do preferencijalne vazodilatacije aferentnih arteriola, povećanja protoka krvi u bubregu (RBF), protoka bubrežne plazme (RPF) i brzine glomerularne filtracija (BGFR) zbog većeg protoka glomerularne krvi. Treba napomenuti da nema promene u frakciji filtracije, jer su i BGFR i RPF povećani. Takođe dovodi do oslobađanja renina, koji kroz sistem renin-angiotenzin izaziva stezanje eferentnih arteriola, što na kraju povećava glomerularni hidrostatički pritisak.
Proces koji pokreće makula denza pomaže da se BGFR održi prilično stabilno kao odgovor na promenljivi arterijski pritisak.
Oštećenje makula denza bi uticalo na bubrežni protok krvi (bubrežni protok krvi, jer se uzlazne arteriole ne bi širile kao odgovor na smanjenje osmolarnosti filtrata, glomerularni pritisak se ne bi povećao. Kao deo regulatora krvnog pritiska u telu, makula denza prati osmolarnost filtrata; ako padne predaleko, izaziva dilataciju bubrežnih aferentnih arteriola, čime se povećava pritisak na glomerul i povećava se brzina glomerularne filtracije.
Izvori
uredi- ^ a b Schnermann, Jürgen B.; Castrop, Hayo (2013), Function of the Juxtaglomerular Apparatus, Elsevier, str. 757—801, Pristupljeno 2023-10-24
- ^ Capasso, Giovambattista; Trepiccione, Francesco; Zacchia, Miriam (2019), The Physiology of the Loop of Henle, Elsevier, str. 42—48.e1, Pristupljeno 2023-10-24
- ^ Bell, P. Darwin; Lapointe, Jean Yves; Peti-Peterdi, János (2003). „Macula Densa Cell Signaling”. Annual Review of Physiology. 65 (1): 481—500. ISSN 0066-4278. doi:10.1146/annurev.physiol.65.050102.085730.
- ^ Maynard, Robert Lewis; Downes, Noel (2019), The Urinary Tract, Elsevier, str. 197—206, Pristupljeno 2023-10-24
- ^ Peti-Peterdi, János; Harris, Raymond C. (jul 2010). „Macula Densa Sensing and Signaling Mechanisms of Renin Release”. Journal of the American Society of Nephrology. 21 (7): 1093—1096. ISSN 1046-6673. PMC 4577295 . PMID 20360309. doi:10.1681/ASN.2009070759.
Spoljašnje veze
uredi| Molimo Vas, obratite pažnju na važno upozorenje u vezi sa temama iz oblasti medicine (zdravlja). |