Азотни оксиди
Појам азотни оксиди се обично односи на бинарна једињења кисеоника и азота или њихова једињења:
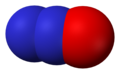
- Азот-моноксид (NO), азот(II) оксид
- Азот-диоксид (NO2), азот(IV) оксид
- Азот-субоксид (N2O), азот (I) оксид
- Азот-триоксид (N2O3), азот(II, IV) оксид, анхидрид азотасте киселине.
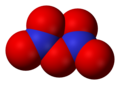
- Азот-тетроксид (N2O4), азот(IV) оксид
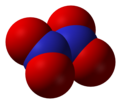
- Азот-пентоксид (N2O5), азот(V) оксид, анхидрид азотне киселине
(Последња три са списка су нестабилна једињења.)
Хемијске реакције које доводе до настанка азотних оксида могу произвести неколико различитих једињења кисеоника и азота (различити пропорционални односи), у зависности од услова саме реакције. Ово је један од разлога зашто су споредни, нуспроизводи N2O непожељни; производња остала два стабилна оксида азота, која су узгред веома отровна, су законом регулисана.
-
Азот-моноксид, NO -
Азот-диоксид, NO2 -
Азот-субоксид, N2O -
Азот-триоксид, N2O3 -
Азот-тетроксид, N2O4 -
Азот-пентоксид, N2O5
NOx
уредиNOx је уопштена форма за моно-азотне оксиде(NO и NO2). Ови оксиди настају приликом процеса сагоревања, нарочито приликом процеса сагоревања на високим температурама.[1][2]
На нормалној, амбијенталној, температури кисеоник и азот не реагују међусобно. Приликом рада мотора са унутрашњим сагоревањем, сагоревање смеше ваздуха и горива производи довољно високу температуру да би изазвало ендотермну реакцију атмосферског азота и кисеоника у пламену. У градовима где је саобраћај густ, количина азотних оксида је приметна и може бити чак и штетна.
У присуству вишка кисеоника (O2), Азот-моноксид (NO) ће реаговати и настаће Азот-диоксид (NO2), а временски период ове реакције зависи од саме концентрације у ваздуху, види се на табели:[3]
| NO концентрација у ваздуху
(ppm) |
Време потребно да се половина присутног NO оксидује у NO2
(min) |
|---|---|
| 20,000 | 0.175 |
| 10,000 | 0.35 |
| 1,000 | 3.5 |
| 100 | 35 |
| 10 | 350 |
| 1 | 3500 |
Када су NOx и неке од органских испарљивих смеша (VOC) заједно у ваздуху, и уз присуство сунчеве светлости, оне формирају фотохемијски смог, који даје велики удео у загађењу природе. Поред загађења ове компоненте и негативно утичу на човеково здравље[4].
- Азот-диоксид, ако се раствори у влаги из ваздуха, формира компоненту (азотну киселину) киселе кише:
- 2NO2 + H2O → HNO2 + HNO3
(Азот-диоксид + вода → азотаста киселина + азотна киселина).
- Затим се азотаста киселина разлаже:
- 3HNO2 → HNO3 + 2NO + H2O
(азотаста киселина → азотна киселина + азот-моноксид + вода),
- Где азот-моноксид реагује са кисеоником, оксидује, и формира азот-диоксид који опет реагује са водом и опет ствара азотну киселина:
- 4NO + 3O2 + 2H2O → 4HNO3
(азот-моноксид + кисеоник + вода → азотна киселина).
Азот-моноксид такође учествује у стварању озона у тропосфери.[5]
Биогенетичко порекло
уредиУ пољопривреди употреба минералних ђубрива и обогаћивање земљишта азотним ђубривима такође припомаже обогаћивању атмосферских NOx, преко процеса денитрификације активне материје из минералног ђубрива помоћу микроорганизмима који поспешују процес.[6][7]
Референце
уреди- ^ Lide David R., ур. (2006). CRC Handbook of Chemistry and Physics (87th изд.). Boca Raton, FL: CRC Press. ISBN 978-0-8493-0487-3.
- ^ Susan Budavari, ур. (2001). The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (13th изд.). Merck Publishing. ISBN 0911910131.
- ^ „NOx Removal”. Branch Environmental Corp. Архивирано из оригинала 8. 10. 2007. г. Приступљено 26. 12. 2007.
- ^ „Health and Environmental Impacts of NOx”. United States Environmental Protection Agency. Приступљено 26. 12. 2007.
- ^ D. Fowler, (1998). „The atmospheric budget of oxidized nitrogen and its role in ozone formation and deposition”. New Phytologist. 139: 11—23. doi:10.1046/j.1469-8137.1998.00167.x.
- ^ J.N. Galloway, (2004). „Nitrogen cycles: past, present, and future”. Biogeochemistry. 70 (2): 153—226. doi:10.1007/s10533-004-0370-0.
- ^ E.A. Davidson & W. Kingerlee (1997). „A global inventory of nitric oxide emissions from soils”. Nutrient Cycling in Agroecosystems. 48: 37—50. doi:10.1023/A:1009738715891.