α,β-Nezasićeno karbonilno jedinjenje
α,β-Незасићена карбонилна једињења су органска једињења опште структуре (О=ЦР)−Цα=Cβ-Р.[1][2] Таква једињења укључују еноне и енале, али и карбоксилне киселине и одговарајуће естре и амиде. У овим једињењима, карбонилна група је коњугована са алкеном (отуда придев незасићен). За разлику од случаја карбонила без бочне алкенске групе, α,β-незасићена карбонилна једињења су подложна нападу нуклеофила на β-угљенику. Овај образац реактивности назива се винилогним. Примери незасићених карбонила су акролеин (пропенал), мезитил оксид, акрилна киселина и малеинска киселина. Незасићени карбонили се могу припремити у лабораторији у алдолној реакцији и у Перкиновој реакцији.
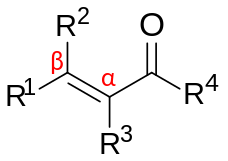
Класификације
уредиα,β-Незасићена карбонилна једињења могу се подкласисати према природи карбонилних и алкенских група.
- Основни α,β-незасићени карбонили
-
Метил винил кетон, најједноставнији α,β-незасићени кетон
-
Акролеин, најједноставнији α,β-незасићени алдехид
-
Метил акрилат, α,β-незасићени естар
-
Акриламид, прекурсор полиакриламида
-
Малеинска киселина, α,β-незасићени дикарбонил
-
Фумарна киселина, изомерна са малеинском киселином
Акрилоил група
уредиα,β-Незасићена карбонилна једињења која садрже карбонил коњугован са алкеном који је терминални или винилни, садрже акрилоил групу (Х2C=ЦХ−Ц(=О)−); то је ацил група изведена из акрилне киселине. Преферирани ИУПАЦ назив за групу је проп-2-еноил, а познат је и као акрилил или једноставно (и нетачно) као акрил. Једињења која садрже акрилоил групу могу се назвати „акрилна једињења”.
α,β-Незасићене киселине, естри и амиди
уредиα,β-незасићена киселина је врста α,β-незасићеног карбонилног једињења које се састоји од алкена коњугованог са карбоксилном киселином.[3] Најједноставнији пример је акрилна киселина (ЦХ2=ЦХЦО2Х). Ова једињења су склона полимеризацији, што доводи до велике површине полиакрилатне пластике. Акрилатни полимери су изведени из, али не садрже акрилатну групу.[4] Карбоксилна група акрилне киселине може да реагује са амонијаком да би се формирао акриламид, или са алкохолом да би се формирао акрилатни естар. Акриламид и метил акрилат су комерцијално важни примери α,β-незасићених амида и α,β-незасићених естара, респективно. Такође се лако полимеризују. Акрилна киселина, њени естри и њени деривати амида садрже акрилоилну групу.
α,β-Незасићени дикарбонили су такође чести. Матична једињења су малеинска киселина и изомерна фумарна киселина. Малеинска киселина формира естре, имид и анхидрид, односно диетил малеат, малеимид и анхидрид малеинске киселине. Фумарна киселина, као фумарат, је интермедијер у Кребсовом циклусу лимунске киселине, што је од великог значаја у биоенергији.
Енони
уредиЕнон (или алкенон) је органско једињење које садржи и алкенске и кетонске функционалне групе. У α,β-незасићеном енону, алкен је коњугован са карбонил групом кетона.[3] Најједноставнији енон је метил винил кетон (бутенон,ЦХ2=ЦХЦОЦХ3). Енони се обично производе помоћу алдолне кондензације или Кноевенагелове кондензације. Неки комерцијално значајни енони произведени кондензацијом ацетона су мезитил оксид (димер ацетона) и форон и изофорон (тримери).[5] У Мејер-Шустеровома реаранжирању, почетно једињење је пропаргил алкохол. Други метод за приступ α,β-незасићеним карбонилима је елиминација селеноксида. Циклични енони се могу припремити путем Паусон-Хандове реакције.
Циклични енони
уредиЦиклични енони укључују циклопропенон, циклобутенон,[6] циклопентенон, циклохексенон и циклохептенон.[7]
Енали
уредиЕнал (или алкенал) је органско једињење које садржи и алкенске и алдехидне функционалне групе. У α,β-незасићеном еналу, алкен је коњугован са карбонил групом алдехида (формил група).[3] Најједноставнији енал је акролеин (ЦХ2=ЦХЦХО). Други примери укључују цис-3-хексенал (есенција покошених травњака) и цинамалдехид (есенција цимета).
- Други α,β-незасићени карбонили
-
Е-кротоналдехид, енал који постоји као изомер
-
Циклохексенон, уобичајени циклични енон
-
тестостерон, мушки полни хормон
-
Циметалдехид, есенција цимета
-
Парахинон, посебно електрофилни α,β-незасићени карбонил
-
Енонски комплекс гвожђе трикарбонила
Реакције α,β-незасићених карбонила
уредиα,β-Незасићени карбонили су електрофилни како на карбонилном угљенику тако и на β-угљенику. У зависности од услова, било које место нападају нуклеофили. Додаци алкену се називају коњугираним адицијама. Једна врста адиција коњугата је Мајклова адиција, која се комерцијално користи у конверзији мезитил оксида у изофорон. Због своје продужене коњугације, α,β-незасићени карбонили су склони полимеризацији. У индустријском обиму, полимеризација доминира употребом α,β-незасићених карбонила. Опет због њиховог електрофилног карактера, алкенски део α,β-незасићених карбонила је добар диенофил у Диелс-Алдеровим реакцијама. Они се даље могу активирати Луисовим киселинама, које се везују за карбонил кисеоник. α,β-Незасићени карбонили су добри лиганди за нисковалентне металне комплексе, примери су Фе(бда)(ЦО)3 и трис(дибензилиденацетон)дипаладијум(0).
α,β-Незасићени карбонили се лако хидрогенишу. Хидрогенација може циљати карбонил или алкен (редукција коњугата) селективно, или обе функционалне групе.
Енони се подвргавају Назаровљевој реакцији циклизације и Рахат-Каријеровој реакцији (димеризација).
α,β-Незасићени тиоестри
уредиα,β-Незасићени тиоестри су интермедијери у неколико ензимских процеса. Два истакнута примера су кумароил-коензим А и кротонил-коензим А. Они настају деловањем ацил-КоА дехидрогеназа.[8] Флавин аденин динуклеотид (ФАД) је неопходан кофактор.
Безбедност
уредиПошто су α,β-незасићена једињења електрофили и агенси за алкиловање, многа α,β-незасићена карбонилна једињења су токсична. Ендогени колектор глутатиона природно штити од токсичних електрофила у телу. Неки лекови (амифостин, Н-ацетилцистеин) који садрже тиол групе могу заштитити од такве штетне алкилације.
Референце
уреди- ^ Патаи, Саул; Раппопорт, Зви, ур. (1989). Енонес: Вол. 1 (1989). Патаи'с Цхемистрy оф Фунцтионал Гроупс. ИСБН 9780470772218. дои:10.1002/9780470772218.
- ^ Патаи, Саул; Раппопорт, Зви, ур. (1989). Енонес: Вол. 2 (1989). Патаи'с Цхемистрy оф Фунцтионал Гроупс. ИСБН 9780470772225. дои:10.1002/9780470772225.
- ^ а б в Смитх, Мицхаел Б.; Марцх, Јеррy (2007). Адванцед Органиц Цхемистрy: Реацтионс, Мецханисмс, анд Струцтуре (6тх изд.). Неw Yорк: Wилеy-Интерсциенце. ИСБН 0-471-72091-7.
- ^ „Ацрyлиц Ацид анд Деривативес”. Уллманн’с Енцyцлопедиа оф Индустриал Цхемистрy. Wеинхеим: Wилеy-ВЦХ. 2005. дои:10.1002/14356007.а01_161.пуб2.
- ^ „Кетонес”. Уллманн’с Енцyцлопедиа оф Индустриал Цхемистрy. Wеинхеим: Wилеy-ВЦХ. 2005. дои:10.1002/14356007.а15_077.
- ^ Росс, А. Г.; Ли, X.; Данисхефскy, С. Ј. (2012). „Препаратион оф Цyцлобутеноне”. Органиц Сyнтхесес. 89: 491. дои:10.15227/оргсyн.089.0491 .
- ^ Ито, Y.; Фујии, С.; Накатуска, M.; Каwамото, Ф.; Саегуса, Т. (1979). „Оне-Царбон Ринг Еxпансион оф Цyцлоалканонес то Цоњугатед Цyцлоалкенонес: 2-Цyцлохептен-1-Оне”. Органиц Сyнтхесес. 59: 113. дои:10.15227/оргсyн.059.0113.
- ^ Тхорпе, Цолин; Ким, Јујнг-Ја П. (1. 6. 1995). „Струцтуре анд мецханисм оф ацтион оф тхе Ацyл-ЦоА дехyдрогенасес”. Тхе ФАСЕБ Јоурнал (на језику: енглески). 9 (9): 718—725. ИССН 0892-6638. ПМИД 7601336. С2ЦИД 42549744. дои:10.1096/фасебј.9.9.7601336 .