Дисулфидна веза
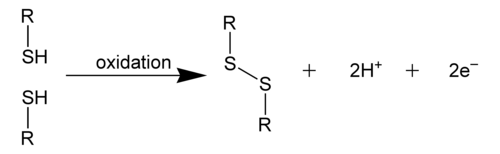
Дисулфидна веза је ковалентна веза, обично настаје спајањем две тиолне групе.[1] Овај линк се такође назива СС-веза или дисулфидни мост. Укупна повезаност је дакле R-S-S-R. Ова терминологија је у широкој употреби у биохемији. Некад се ова веза називала персулфид, по аналогији са конгенерним пероксидом (R-O-O-R), али је та терминологија незаступљена.
Особине
уредиДисулфидна веза је јака. Њена типична енергија дисоцијације везе је 60 kcal/mol. Она је око 40% слабија од C-C и C-H веза, и стога се дисулфидна веза често назива "слабим линком" у многим молекулима. Осим тога, одражавајући поларизабилност двовалентниг сумпора, С-С веза је подложна цијепању поларним реагенсима електрофилима а посебно нуклеофилима.[2]
- RS-SR + Nu- → RS-Nu + RS-
Дисулфидна веза је око 2.05 Å дугачка, што је 0.5 Å дуже од C-C везе. Ротација око S-S осе има ниску баријеру. Дисулфиди показују изразиту склоност за диедралне углове који се приближавају углу од 90°. Када је угао близо 0° или 180°, дисулфид је знатно бољи оксидациони агенс.
Дисулфиди са две исте R групе су симетрични. Примери таквих једињења су дифенил дисулфид и диметил дисулфид. Асиметрични дисулфиди имају две различите Р групе.[3]
Иако хидрогенација дисулфида обично није практична, константа равнотеже ове реакције може да служи као мера стандардног редокс потенцијала дисулфида:
- RSSR + H2 → 2 RSH
Ова вредност је око -250 mV (pH = 7). У поређењу с тим, стандардни редукцини потенцијал феродоксина ја око -430 mV.
Референце
уреди- ^ Доналд Воет; Јудитх Г. Воет (2005). Биоцхемистрy (3 изд.). Wилеy. ИСБН 9780471193500.
- ^ Цремлyн, Р. Ј. W. (1996). Ан интродуцтион то органосулфур цхемистрy. Неw Yорк: Wилеy. ИСБН 978-0-471-95512-2.
- ^ Севиер, C. С. & Каисер, C. А. (2002). „Форматион анд трансфер оф дисулпхиде бондс ин ливинг целлс”. Натуре Ревиеwс Молецулар анд Целлулар Биологy. 3 (11): 836—847. ПМИД 12415301. дои:10.1038/нрм954.
Литература
уреди- Села M, Лифсон С (1959). „Тхе реформатион оф дисулфиде бридгес ин протеинс”. Биоцхим Биопхyс Ацта. 36 (2): 471—8. ПМИД 14444674. дои:10.1016/0006-3002(59)90188-X.
- Старк ГР.; Стерн, К; Атала, А; Yоо, Ј (1977). „Цлеаваге ат цyстеине афтер цyанyлатион”. Метходс Ензyмол. 47: 129—32. ПМИД 927170. дои:10.1016/ј.yметх.2008.09.005.
- Тхорнтон ЈМ. (1981). „Дисулпхиде бридгес ин глобулар протеинс”. Ј Мол Биол. 151 (2): 261—87. ПМИД 7338898. дои:10.1016/0022-2836(81)90515-5.
- Тханнхаусер ТW, Конисхи Y, Сцхерага ХА (1984). „Сенситиве qуантитативе аналyсис оф дисулфиде бондс ин полyпептидес анд протеинс”. Анал Биоцхем. 138 (1): 181—8. ПМИД 6547275. дои:10.1016/0003-2697(84)90786-3.
- Wу Ј, Wатсон ЈТ (1998). „Оптимизатион оф тхе цлеаваге реацтион фор цyанyлатед цyстеинyл протеинс фор еффициент анд симплифиед масс маппинг”. Анал Биоцхем. 258 (2): 268—76. ПМИД 9570840. дои:10.1006/абио.1998.2596.
- Футами Ј, Тада Х, Сено M, Исхиками С, Yамада Х (2000). „Стабилизатион оф хуман РНасе 1 бy интродуцтион оф а дисулфиде бонд бетwеен ресидуес 4 анд 118”. Ј Биоцхем. 128 (2): 245—50. ПМИД 10920260.
- Wиттенберг, Г, Данон, А (2008). „Дисулфиде бонд форматион ин цхлоропластс: Форматион оф дисулфиде бондс ин сигналинг цхлоропласт протеинс”. Плант Сциенце. 175 (4): 459—466. дои:10.1016/ј.плантсци.2008.05.011.
- Кадокура, Хиросхи; Катзен, Федерицо; Бецкwитх, Јон (2003). „Протеин Дисулфиде Бонд Форматион ин Прокарyотес”. Аннуал Ревиеw оф Биоцхемистрy. 72: 111. ПМИД 12524212. дои:10.1146/аннурев.биоцхем.72.121801.161459.
- Ту, Б. П.; Wеиссман, ЈС (2004). „Оxидативе протеин фолдинг ин еукарyотес: мецханисмс анд цонсеqуенцес”. Тхе Јоурнал оф Целл Биологy. 164 (3): 341. ПМЦ 2172237 . ПМИД 14757749. дои:10.1083/јцб.200311055.
- Еллгаард, Ларс; Руддоцк, Ллоyд W. (2005). „Тхе хуман протеин дисулпхиде исомерасе фамилy: субстрате интерацтионс анд фунцтионал пропертиес”. ЕМБО репортс. 6 (1): 28. ПМЦ 1299221 . ПМИД 15643448. дои:10.1038/сј.ембор.7400311.
- Цремлyн, Р. Ј. W. (1996). Ан интродуцтион то органосулфур цхемистрy. Неw Yорк: Wилеy.