Трансаминација
Трансаминација, хемијска реакција којом се преноси амино група на кетокиселину чиме се формира нова аминокиселина. Овај приступ је одговоран за деаминацију већине аминокиселина. Ово је један од главних деградационих путева којим се конвертују есенцијалне аминокиселине у неесенцијалне аминокиселине (аминокиселине које могу да буду синтетисане де ново у организму).[1]
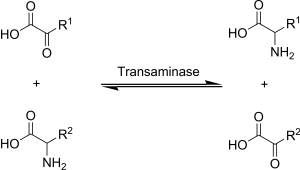
Трансаминација се у биохемији остварује посредством ензима званог трансаминаза или аминотрансфераза. α-кетоглутарат делује као предоминантна акцепторска аминогрупа и производи се глутамат као нова аминокиселина.
- Аминокиселина + α-кетоглутарат ↔ α-кетокиселина + Глутамат
Глутаматна амино група бива пренесена на оксалоацетат у другој реакцији трансаминације чиме настаје аспартат.
Механизми дејства
уредиАминотрансферазом катализована трансаминација се одвија у два ступња. У првом ступњу, α амино група аминокиселине се преноси на ензим, и формира се кореспондирајућа α-кетокиселина и аминовани ензим. Током другог ступња, амино група се преноси на кетокиселински акцептор, чиме се формира аминокиселински производ уз регенерацију ензима. Хиралност аминокиселине бива одређена током трансаминације. Да би реакција могла да се одвија, аминотрансферази је неопходан коензим који садржи алдехид, пиридоксил-5'-фосфат (ПЛП), дериват пиридоксина (витамина Б6). Амино група се прихвата конверзијом овог коензима у пиридоксамин-5'-фосфат (ПМП). ПЛП је ковалентно везан за ензим као Шифова база, везом која је формирана кондензацијом његове алдехидне групе са ε-амино групом једног ензимског Lys остатка. Шифова база, која је коњугована на ензимски пиридинијумски прстен је фоцус коензимске активности.
Продукат реација трансаминације зависи од доступности α-кетокиселина. Продукти су обично било аланин, аспартат или глутамат, пошто су њихове кореспондирајуће алпха-кетокиселине формирају путем метаболизма горива. Лизин, пролин и треонин су једине три аминокиселине које увек не подлежу трансаминацији, већ радије користе респективну дехидрогеназу.
- Алтернативни механизам
Други тип реакције трансаминације се може описати као нуклеофилна супституција једног аминског или амидног ањона на аминској или амонијумској соли.[2] На пример, напад на примарни амин примарним амидним ањоном се може користити за припремање секундарних амина:[3]
- RNH2 + R'NH− → RR'NH + NH2−
Симетрични секундарни амини се могу припремити користећи Рејнијев никел (2RNH2 → R2NH + NH3). Кватернарне амонијум соли могу да буду деалкиловане користећи етаноламин:
- R4N+ + NH2CH2CH2OH → R3N + RN+H2CH2CH2OH
Аминонафталени исто тако подлежу трансаминацији.[4]
Типови аминотрансфераза
уредиТрансаминацију посредује неколико различитих аминотрансферазних ензима. Они могу да буду специфични за индивидуалне аминокиселине, или могу да имају способност деловања на хемијски сродним киселинама. Каснији сценарио важи за групу аминокиселина са разгранатим бочним ланцом, која обухвата леуцин, изолеуцин и валин. Два широко заступљена типа аминотрансфераза су аланинска аминотрансфераза (АЛТ) и аспартатна аминотрансфераза (АСТ).
Референце
уреди- ^ Доналд Воет; Јудитх Г. Воет (2005). Биоцхемистрy (3 изд.). Wилеy. ИСБН 9780471193500.
- ^ Боотх, Гералд (2000-01-01). „Напхтхалене Деривативес”. Уллманн'с Енцyцлопедиа оф Индустриал Цхемистрy. Wилеy-ВЦХ Верлаг ГмбХ & Цо. КГаА. ИСБН 9783527306732. дои:10.1002/14356007.а17_009.
- ^ Смитх, M. Б. анд Марцх, Ј. Адванцед Органиц Цхемистрy: Реацтионс, Мецханисмс, анд Струцтуре, 5тх ед. Wилеy, 2001, п. 503. ISBN 0-471-58589-0
- ^ Боотх, Гералд (2000). „Напхтхалене Деривативес”. Уллманн'с Енцyцлопедиа оф Индустриал Цхемистрy. Wеинхеим: Wилеy-ВЦХ. ИСБН 978-3-527-30385-4. дои:10.1002/14356007.а17_009.
Спољашње везе
уреди- Amino Acid Biosynthesis Архивирано на сајту Wayback Machine (26. април 2017)
- The chemical logic behind aminoacid degradation and the urea cycle