Злоћудни рак кестењаче
Злоћудни рак кестењаче или карцином простате (МКБ10 Ц61) је један од најчешћих злоћудних (малигних) тумора код мушкараца који може да даје удаљене метастазе. По смртности у мушкој популацији, спада у сам врх најчешћих карцинома заједно са бронхопулмоналним и колоректалним карциномом. У највећем броју случајева, манифестује се у облику аденокарцинома, мада није искључена његова појава (додуше ретко) као планоцелуларног карцинома, али веома ретко. Дакле, у питању је малигни тумор који настаје у простати и може да даје удаљене метастазе.
| Карцином простате | |
|---|---|
| Синоними | Рак кестењаче |
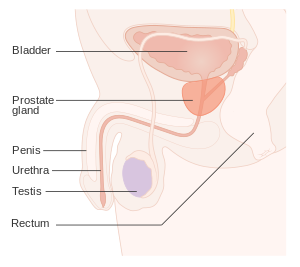 | |
| Анатомија простате | |
| Специјалности | онкологија |
| Прогноза | 5 година у 99%[1] |
| Фреквенција | 1.1 милион случаја (2014)[2] |
| Смртност | 307.000 (2014)[2] |
Поједини епидемиолошки подаци указују на то да за настанак карцинома простате постоји и генетска предиспозиција. Такодје, гојазност и прекомерно уношење масти животињског порекла такође су неки од значајаних фактор ризика у настанку овог карцинома. Мада постоје и теорије о хормоналном окидачу, као узроки карцинома (јер де он не развијају код евнуха, а и показују смањење уколико дође до андрогене аблације), каои неке недовољно потврђене о инфекцијама (бактеријски простатитис и неке вирусне инфекције изазване вирусом херпеса, хуманим папилома вирусом, цитомегаловирусом), као могућем узроку.
Епидемиологија
уредиУ развијеним земљама карцином простате чини 15% карцинома мушкараца док је у земљама у развоју тај број нижи (4%). У оквиру Европе такође постоје велике регионалне разлике у стопи инциденције карцинома простате. Студије обдукцијског материјала су показале да је у већини популација света преваленција рака простате у муπкараца изнад 50. године живота доста конзистентна ∑ између 15 и 30%. Претпоставља се да су фактории иницијације карциногенезе у начелу слични, а да различитост постоји у стопама јављања или прогресије болести.[3] Карцином простате представља једну од најчешћих неоплазми у хуманој медицини заједно са броххопулмоналним и колоректалним карцином. Задњих година заузима прво место по учесталости (17-21%) и друго место по смртности међу свим карциномима у САД али и све више и у Европи. Карцином простате сваке године буде откривен код 181.000 мушкараца у САД, а у 2016. години од овог малигног тумора умрло је њих 26.000. Просечна старост оболелих је 66 година, јер болест ретко напада мушкарце млађе од 40 година.
Недавно истраживање у САД показало је и да се између 40 и 50 одсто мушкараца оболелих од рака простате радије одлучује за активни надзор болести, а Америчко друштво за рак навело је да већина пацијената не умире јер болест напредује веома споро, али да у неким случајевима може бити смртоносна. На ово указују утврђене чиwенице да рак простате има мало вероватноћу да му оболела особа подлегну у наредних 10 година, без обзира на то да ли су подвргнути операцији или радиотерапији, показала је студија објављена у САД. Пацијенти под активним надзором имали су већи ризик од метастазирања тумора, али је степен њихове смртности био само незнатно већи од смртности изазване другим врстама тумора или било којим другим фактором.[4]
У Србији се сваке године региструје 2.300 до 2.400 новооткривених случајева карцинома простате, према подацима Института за јавно здравље „Батут” из Београда: После рака плућа, он је најчешћи малигнитет код мушкараца у Србији, а трећи узрок смрти, када су у питању малигне болести (после рака плућа и дебелог црева). Годишње од ове врсте рака умре близу 800 мушкараца. Практично, рак простате је за мушкарцел исти „пошаст” (и ризик) као што је тумор дојке код жена.
Етиопатогенеза
уредиТри добро позната фактора ризика за настанак карцинома простате су: старење, етничка припадност и генетска предиспозиција. Клинички подаци указују да егзогени фактори ризика као што су дијета, сексуално понашање, конзумирање алкохола, изложеност ултравиолетним зрацима, професионална изложеност такође играју значајну улогу у настанку карцинома простате.
- Патохистолошке промене код злоћудног рака кестењаче
-
Нормална кестењача
-
Интарепителна неоплазија кестењача(ПИН)
-
Карцином ацинусног типа
-
Диференцирани карцином
-
Метастаза костију и меког ткива у карциному кестењача са имунохистохемијским доказима ПСА експресије (браон)
ТНМ калсификација карцинома простате.[5]
| Т – Примарни тумор |
|
|
| Т – Примарни тумор |
|
|
| Т – Примарни тумор |
|
|
| Т – Примарни тумор |
|
|
| Т – Примарни тумор |
| |
| Н – регионалне лимфне жлезде |
|
|
| M – Удаљене метастазе |
|
|
Ентитет рака простате није лако интерпретирати; он се састоји од три разлиËите компоненте:
- клинички рак простате (симптоматски случајеви код којих је могужа клиничка дијагноза),
- окултни рак простате (примарна лезија остаје мала или скривена, али се клинички манифестује метастазама) и
- латентни рак простате (са клинички непрепознатљивим знацима и симптомима). Овај облик најчешће је неочекивани налаз при трансуретралној ресекцији простате због бенигне хиперплазије простате или се открије селекцијом коду асимптоматских болесника.[6]
Фактори ризика
уредиФактори ризика за карцином простате засад нису сасвим познати избог тога није могуће деловати превентивно на развој ове болести. Међу многобројним факторима за које се претпоставља да могу бити узрок болести за сада се највише спомињу: старост, расна припадност и породична предиспозиција.
- Старост
Старост болесника је најважнији фактор ризика за развој карцинома простате. Од карцинома простате ретко болују мушкарци млађи од 40 година, а инциденција расте након 60-те године старости са максимумом око 80. године живота.[7] Ризик обољевања од карцинома простате обрнуто је пропорционалан старости болесника и независтан је од фактора средине, пушење, пијење алкохола и физичка активности. Управо због тога што се ради о млађој мушкој популацији, препоручљиво је започети дијагностику за карцином простате већ са 40 година старости.[8]
- Расне разлике
Највећи ризик за оболијевање имају Афро-Американци који имају 1.6 пута већу инциденцију карцинома уз 2.5 пута већи морталитет него популација беле расе у Северној Америци. Мушкарци који су се преселили из зоне ниске инциденције у зону високе стопе инциденције имају исту ризик као и мушкарци у месту доласка.
Азијати имају најмањи ризик за обољевање што се покушава објаснити другачијом исхраном.[9] Тестостерон директно стимулише раст нормалних ћелија ткива простате и ћелија рака простате. Познато је да евнуси не обољевању од карцинома простате, уколико су кастрирани пре пубертета, а такође се болест ретко јавља код болесника са хиперестринизмом због цирозе јетре.[10]
- Исхрана
Бројне студије указују на то да повећани унос масти животињског порекла и црвеног меса повећава ризик за настанак карцинома.[11]
Југоисточни Азијати традиционално конзумирају соју која садржи значајну количину фитоестрогена, а управо та популација има најнижу стопу карцинома простате у свету.
Фактори који делују протективно су ликопен и каротеноиди из парадајеза и шаргарепе.[12]
- Генатска предиспозиција
Код карцинома простате описане су различите хромозомске абнормалности. Најчешће се јављају адиције на хромозомским локусима 1q, 2п, 7q, 8q, 18q и Xq, а делеције на 1п, 6q, 8п, 10q, 13q, 16q и 18q.[13]
Сматра се да је 5-10% карцинома простате примарно изазван високо ризичним наследним генетским факторима. Резултати студија указују да мушкарац има 3,3 пута већу веројатноћу за развој карцинома простате уколико је у портодици брат или отац боловао од карцинома простате.
Клиничка слика
уредиКарцином простате не даје ни један специфичан симптом (јер су симптоми карактеристични за више обољења простате, не само за карцином) – у томе и лежи његова подмуклост и скривена опасност. Како је карцином простате најчешће спорорастући тумор, осим код мушкараца млађе животне доби већина карцинома простате дијагностикује се у асимптоматском стадију на основу повишене вриједности ПСА која затим индицира биопсију простате.[14]
Међу најзначајнијим симптомима карцинома простате су:
- учестало ургентног мокрења са ослабљелим млазом мокраће.
- ноћно мокрење,
- лажни нагон за мокрењем
- промена јачине млаза,
Иако су то неспецифични симптоми који се јављају и у болесника с бенигном хиперплазијом простате, симптоми код карцинома простате се временом интензивирају. Прре открића ПСА, пацијенти са карциномом простате са симптомима уринарне ретенције, боловима у леђима и хематуријом, најчешће су били знаци узнапредовале болести.
Компликације и ширење тумора
уредиНајчешће компликације су потпуна ретенција урина, уринарне инфекције, калкулоза и инсуфицијенција бубрега. Периферно лоцирани карциноми простате имају тенденцију ширења перинеуралном инвазијом.
Екстрапростатично ширење тумора се јавља постериорно и постеролатерално. Врло се ретко карцином простате директно шири у ректум због препреке коју чини Денонвиллиерова капсула. Директно захватање семених врећица је најзначајнији фактзор ризика за појаву удаљених метастаза и смрти од карцинома простате.[15]
Узнапредовали карцином последица је локалног ширења, лимфогених и хематогених метастаза. Карцином простате има посебну предилекцију метастазирања у кости, а осим тога метастазира и у плућа, јетру и мозак.[16]
Манифестација метастатског карцинома простате може бити губитак телесне масе и губитак апетита, анемија, бол у костима са или без патолошке фрактуре те неуролошки симптоми због компресије на краљежничну мождину. Као последица венске или лимфатичне опструкције јављају се едем ногу или бол у ногама.
Уремични симптоми могу се појавити због опструкције уретера узроковане локалним растом простате или као последица метастаза у ретроперитонеалне лимфне чворове.[17]
Клиничка слика
уредиКлиничка слика може бити у раном стадијуму болести простате потпуно одсутна да би потом доминирали опструктивни симптоми (дизурија, ноктурија, слабљење јачине млаза и тањи млаз) који нису специфични само за карцином простате већ и за њен дијагностички пандам бенигну хиперплазију простате (скраћено БПХ) и друга субвезикална опстуктивна обољења.
У терминалној фази карцинома простате клиничком сликом доминирају знаци метастатске болести као што су болови у коштаном систему где су најчешће метастазе, затим општи знаци слабости, губитка телесне тежине, анемија.
Због овакве клиничке слике болест се најчешће откривала или у завршној фази метастатске болести или акцидентално у покушају хируршког лечења БПХ.
Дијагноза
уредиВећина случајева рака кестењаче дијагностикује се у асимптоматској фази. Промене у кестењачи откривене ректалним прегледом и абнормални нивои ПСА су основне претпоставке за извођење трансректалне биопсије кестењаче, током које се прикупља ткивни материјал за хистопатолошки преглед, што је основа за постављање дијагнозе карцинома кестењаче.[18]
У дијагнози карцинома простате користи се дијагносткички алгоритам који подразумева:
- утврђивање клиничке слике,
- дигиторектални преглед простате (ДРЕ; РТ),
- одређивање вредности серумског ПСА,
- буохемијске анализе,
- сцинтиграфија скелета,
- компјутеризована томографија и магнетна резонанца,
- трансабдомианлни ултразвучни преглед,
- трансректални ултразвучни преглед (ТРУС ) и
- трансректалну ултразвуком вођену биопсију простате.
До почетка примене одређивања простата специфичног антигена скраћено (ПСА) од 1980-их година који се до данас доказао као најбољи маркер за дијагнозу карцинома простате, сумња на ово обољење се постављала на основу неспецифичне клиничке скике и дигиторекталног прегледа.[19] Циљ дијагностике без обзира на примењену методу је да се дијагностикује што више карцинома простате онда када постоје највеће шансе за успешно излечење.[20]
Дигиторектални преглед
уредиДигиторектални преглед (скраћено DRE) може са великом вероватноћим указати на присуство карцинома али такође не у најранијој фази већ са све већом специфичношћу што је болест више одмакла. У стадијуму Т1 карцином простате је непалпабилан, а они чине 20—25% свих карцинома простате. „Detection rate“ ако се користи само ДРЕ је низак и износи само 0,8—1,4%. Са друге стране 50% суспектног налаза ДРЕ не представља карцином простате већ су биопсијом нађени инфламаторни процеси: калкулоза простате, грануломатоза или туберкулоза. Дијагностичка тачност ДРЕа се процењује на 50-75% .
Биохемиске анализе
уредиБиохемиске анализе, сем донекле киселе простатичне фосфатазе и алкалне фосфатазе, нису биле од помоћи код дијагностиковања карцинома простате.
Ултразвучна дијагностика
уредиТрансабдоминални ултразвук даје поуздане информације само о величини простате али тек делом о њеној структури. Посредно је могао да изазове сумњу на карцином код једностране хидронефрозе ако се искључе други узроци као калкулоза, тумор уртера, стенозе и други ређи узроци.
Трансректални ултразвук (енгл. „transrectal ultrasound“ (TRUS)) даје бољу и прецизнију слику простате пошто сонду од простате дели само зид ректума. Такође, процена волумена простате је прецизнија код овог начина извођења ултразвучног прегледа када уочавамо зоналну архитектонику у грађи простате4 или лезије у периферној или транзиторној зони. Ове лезије код карцинома простате могу бити хипоехогеног изгледа што је најчешће (70%) али такође и изоехогене (31-39%), или хиперехогене (1%). Уочавамо симетричност у облику простате, односно да ли неки режањ или његов део проминира и мења облик простате. Процењује се да ли постоји екстракапсуларно ширење процеса било у околину простате или у семене кесице или врат мокраћне бешике. У Т1 стадијуму, који је непалпабилан, карциномске лезије се ТРУС-ом визеализују код око 13% пацијената.[21]
Код одређивања екстракапсуларне инвазије ТРУС није показао боље резултате од ДРЕ.[21]
Ултразвучни апарати који дају 3Д слику повећавају сензитивност и специфичност овог дијагностичког поступка. ТРУС са Доплеровим ефектом који показује зоне појачаног протока крви у периферној зони простате може са већом сигурношћу указати на канцерске лезије. Још већа сензитивност и осетљивост се постиже комбиновањем, апликације контраста у крвоток и колор-доплер ултразвука када се та метода назива „Power-Doppler“ ултразвук.
Компјутеризована томографија и магнетна резонанца
уредиКомпјутеризована томографија (скраћено ЦТ) има мали значај у градирању пацијената са малим и средњим ризиком а показује већи дијагностички значај у Т3 и Т4 стадијуму. Већу дијагностичку вредност има магнетна резонанца - МРИ а поготову ендоректални МРИ и МРС (спектроскопија магнетном резонанцом).
Велику специфичност и сензитивност има и ПЕТ скенер сем код ниских вредности ПСА испод 5 нг/мл.[22]
Сцинтиграм скелета
уредиСцинтиграм скелета се користи за откривање коштаних метастаза а изводи се уколико је ПСА изнад 15 нг/мл.
ПСА
уредиТек са широм клиничком применом простата специфичног антигена (скраћено ПСА) могло је са већом поузданошћу поставити сумњу на присуство карцинома простате. Са друге стране, увођењем овог туморског маркера настала је и од многих названа тзв. „ера терора ПСА“ пошто свако увећање вредности ПСА изискује додатно ангажовање пацијента додатно време и додатна материјална средства да би се доказало да та елевација ПСА не представља и присуство карцинома простате.
У циљу повећања поузданости овог туморског маркера уведени су разни деривати ПСА као што су ПСАД („ПСА денсити“) који указује на значај величине простате пошто већа простата ствара више овог ензима, ПСА-Тз („ПСА транзиторy зоне“), „ПСА велоцитy“ који прати повећање ПСА у временском интервалу, индекс „ПСА фрее/ПСА тотал“ - однос слободног и укупног ПСА које нам ближе говори о природи повишења овог биомаркера. У клиничкој пракси најчешће секористи однос слободног и тоталног ПСА. Гранична вредност је прво била 0,15 односно 15% при чему су вредности изнад 0,15 су ишле у прилог бенигног обољења а испод ове вредностису указивале на малигнитет. Сада је ова граница подигнутана 0,2 али и на 0,25.[23]
ПСА треба рутински радити код мушкараца старијих од 50 година а код позитивне породичне анамнезе почев од 40.године. Горња граница узета као најбољи одност сензитивностии специфичности је 4 нг/мл. Ипак и када је ПСА испод 4 нг/мл код 10—20% биопсија простате може бити позитиван. Посебан проблем представља „сива зона“ односно вредности ПСА од 4,1—10 нг/мл где су сензитивност и специфичност 57% и 68%, а генерална сензитивноси и специфичност овог туморкогмакера су 80% и 30%.7 Однос слободног и тоталног ПСА (ф/тПСА) има већу специфичност уз исту сензитивност. Поједини ауториграничну вредност за тотални ПСА код млађих пацијената спуштају на 3 нг/мл а други иду још даље па биопсију простатераде када вредност укупног ПСА прелази 2,5нг/мл.
Биопсија простате
уредиГлавне дилеме које мора да реши уролог који жели да дијагностикује или искључи постојање карцинома кестењаче, су:
- када урадити биопсију простате,
- колико пута урадити поновну биопсију кестењаче код негативног предходног налаза,
- када поновити биопсију, пре него што се искључи малигно обољење кестењаче,
- колики је оптимални број иглених узорака,
- са којих места узети узорак, при извођењу биопсије кестењаче.
- Индикације за биопсију простате
Према досадашњим сазнањим биопсију простате би требало радити:
- када је ПСА изнад 4 нг/мл односно изнад 3 нг/мл код млађих болесника,
- када постоји абнормалност код ректалног тушеа
- када постоји абнормалност код трансректалног ултразвука
- када постоји абнормалност код више дијагностичких процедура а клиничка слика је нејасна.
Терапија
уредиТерапијске могућности за пацијенте са карциномом простате деле се у клиничкој пракси на основу стејџинга и дијагнозе. Обзиром на недостатак рандомизованих контролисаних студија о карциному простате не може се дати предност ни једној терапијској опција. Без обзира на то на основу садашњих сазнања из литералурних направљене су препоруке које су презентоване у наставку текста. На избор лечења утиче више фактора: старост пацијента, опште стање организма, стање срца и плућа, стадијум развоја тумора као и степен малигнитета, нежељени ефекти и могуће компликације различитих начина лечења...
- Терапија интрапростатичних тумора
Код интрапростатичних тумора терапија се заснива на:
- Праћењу тока болести (не предузима се ништа, већ се стање редовно прати кроз редовне контроле)
- Радикална операција простате (уклањање комплетне простате посебном хируршком интервенцијом)
- Терапија зрачењем
- Терапија тумора у узнапредовалом стадијуму
Код узнапредовалог стадијума тумора терапија се заснива на:
- Ендокрина терапија (која има за циљ да смањи дејство мушких полних хормона који стимулишу раст тумора, а то се постиже операцијом — уклањањем тестиса или лековима)
- Примени више комбинованих метода
Хируршко лечење
уредиЛечење рака простате најчешће обухвата хируршки приступ који подразумева радикалну простатектомију (одстранивање читаве простате), која се може обавити применом више приступа. Уколико је дијагноза постављена на време, прогноза је добра код око 85% пацијената.
- Лапароскопска простатектомија
Лапароскопска простатектомија или радикална лапороскопска простатектомије (скраћено РЛП) је минимално инвазивна хируршка уролошка процедура која подразумијева, као и код отворене операције; уклањање целе простате са тумором, семених кесица и реконструкцију уретре директно на врат мокраћне бешике. Ова интервенција спада у најтеже уролошке лапароскопске операције.[24][25][26]
Кривуља учења ове методе је дуга, према објављеним студијама тек се након стотинак операција постижу резултати упоредиви сс онима код отворених операција. У новијим студијама учесталост позитивних рубова и импотенције приближава се резултатима објављеним код отворених операција. Такођер су успоредиви и рани онколошки резултати; учесталост биохемијског рецидива болести подједнака је оној код отворених операција. Ипак, предности лапароскопске радикалне простатектомије у односу према отвореној операцији нису тако јасно изражене као што је код лапароскопских уролошких операција горњег дела уринарног тракта.[27]
Радиотерапија
уредиУ лечењу се најчешће примјењују; конформална (3Д) радиотерапија и брахитерапија које готово једнако даје добре резултате као и хируршко лечење.
Радикална радиотерапија је алтернатива хируршком лечењу код локализованог облика карцинома простате. Лечење радиотерапијом показало је добре резултате, али у поређењу са радикалном простатектомијом још увијек даје нешто слабије резултате.[28]
- Радиотерапија спољашњим снопом
Данас се претежно примјењује радиотерапија спољашњим снопом (3Д конформална радиотерапија) која уз помоћ компјутерског софтвареа интегрише ЦТ-слике пацијентове анатомије у тродимензионалном положају у којем се примјењује радиотерапија простате. Тиме је омогућена већа сигурност при одређивању циљних волумена карцинома, већа поузданост приликом примене дозе зрачења за одабрано подручје и мање озрачивање околног ткива.[29]
Код примене радиотерапије спољашњим снопом постоји врло мали ризик од развоја уринарне инконтиненције и стриктура, а краткорочно ова меода чува еректилну функцију код већине пацијената.
Недостатак радиотерапије спољашњим снопом је:
- дужина трајања (8-9 недеља),
- 50% пацијената има тегобе од стране црева,
- импотенција се временом погоршава.[30]
- Брахитерапија
У лечењу се примијењује и брахитерапија (уградња радиоактивног извора у ткиво простате). За ту намену користе се трајни имплантати радиоактивног јода (I-125) и паладијума (Пд-103) као и привремени имплантати иридијума (Ир-192) који постепено губећи радиоактивност уништавају ћелије карцинома простате.[31]
Предност брахитерапије је да се може примиенити у једном дану и очување еректилне функције у већем броју пацијената него што је то случај код лечених другим методама.[31]
- Салваге радиотерапија
Ова врсте радиотерапија је метода која се примјењује код пацијената који развију биохемијски релапс болести након радикалне простатектомијер. Тај облик радиотерапије је једини потенцијално куративни облик лечења за болеснике с порастом ПСА након хируршког лечења. Новија истраживања показују да је највећа корист од салваге радиотерапије кад се примјењује при концентрацији ПСА мањој од 1 нг/мЛ.[32]
Хормонска терапија
уредиУ току су научна испитивања бројних терапијских могућности које ће вероватно представљати будућност у лечењу карцинома простате, али за сада због недостатка дуготрајнијих епидемиолошких студија, није могуће рећи ништа са сигурношћу о њиховој ефикасности. Тренутно ова врста терапије се примењује код:
- Стадијума Т1а-Т2ц карцинома простате
- Као самостална терапија код симптоматских пацијента, којима је потребна палијација симптома, који нису у кондицији за курабилни третман. У овој терапији примена анти андогена се не препоручује.
- Као комбинована терапија, која код пацијената са високим ризиком, применом неоадјувантне хормонске терапије и конкомитантне хормонске терапија + радиотерапија повећава укупно преживљавање болесника
- Стадијума Т3-Т4 карцинома простате
- Код симптоматских пацијента, код којих је ПСА > 25–50 нг/ мл. ПСА „доублинг тиме“ (ДТ) < 1 године.
- Стадијума Н+, Мо карцинома простате
- Као стандардна адјувантна терапија након радиотера - пре или након радикалне простатектомије код пацијената са више од 1 позитивном лимфном жлездом. Код ових болесника хормонска терапија се примењује као монотерапија само у пацијената који нису у кондицији за било који други третман.
- Као комбинована терапија без стандардних препорука
Превенција
уреди- Примарна превенција
С обзиром на садашње недовољно познавање фактора ризика, перспективе за примарну превенцију карцинома простате су слабе.
- Секундарна превенција
У секундарној превенцији као методе избора препоручује се:
- годишњи превентивни дигиторектални преглед простете,
- утврђивање нивоа простата специфичног антигена (ПСА, укупног, а могуће је одредити и вредност слободног ПСА - ∑ ФПСА) код мушкараца старијих од 50 година.
Код мушкараца са повећаним ризиком за рака простате са превентивним прегледима треба започети у ранијој животној доби.
Извори
уреди- ^ „Цанцер Стат Фацтс: Простате Цанцер”. Натионал Цанцер Институте . УСА.гов. Приступљено 9. 12. 2017.
- ^ а б Wорлд Цанцер Репорт 2014. Wорлд Хеалтх Организатион. 2014. пп. Цхаптер 1.1. ISBN 9789283204299.
- ^ Strnad M, Znaor A, Šamija M (1998). „Epidemiology of prostate cancer.”. Libri Oncol. 27 (2–3): 95—107.
- ^ Merrill, R. M.; Stephenson RA. (2000). „Trends in mortality rates in patients with prostate cancer during the era of prostate specific antigen screening”. Journal of Urology. 163 (2): 503—10. PMID 10647666. doi:10.1016/S0022-5347(05)67912-8..
- ^ A. Heidenreich, M. Bolla, S. Joniau, M.D. Mason, V. Matveev, N. Mottet, H-P. Schmid, T.H. van der Kwast, T. Wiegel, F. Zattoni, Vodič za karcinom prostate, Evropsko udruženje urologa, Udruženje Urologa Srbije 67. Vodič za 2012
- ^ Boyle P, Maisonneuve P, Napalkov B. Incidence of Prostate Cancer Will Double by the year 2030: The Argument For. Eur Urol 1996; 29 (suppl 2):3-9.
- ^ Center, M. M.; Jemal, A; Lortet-Tieulent J i sur (2012). „International variation in prostate cancer incidence and mortality rates”. Eur Urol. 61: 1079—92.
- ^ Carter, B. S.; Bova GS; Bety TH i sur (1993). „Hereditary prostate cancer: epidemiologic and clinical features”. Journal of Urology. 150: 797—802..
- ^ Albano, J. D.; Ward, E; Jemal A i sur (2007). „Cancer mortality in the United States by education level and race”. J Natl Cancer Inst. 99: 1384—94.
- ^ Yokoyama M, Seki N, Tamai M, Takeuchi M (1989). „Benign prostatic hyperplasia in patients castrated in his youth”. Journal of Urology. 142: 134—5.
- ^ Bosland MC, Oakley-Girvan I, Whittemore AS (1999) Dietary fat, calories, and prostate cancer risk. J Natl Cancer Inst;91:489.
- ^ Giovannucci E, Rimm EB, Liu Y i sur. (2002) A prospective study of tomato products, lycopene, and prostate cancer risk. J Natl Cancer Inst;94:391.
- ^ Reynolds, M. A. (2008). „Molecular alterations in prostate cancer”. Cancer Lett. 271: 13—24.
- ^ Catalona, W. J.; Richie JP; De Kernion JB (1994). „Comparison of prostate specific antigen concentrations versus prostate specific antigen density in the early detection of prostate cancer: Receiver operating characteristics courves”. Journal of Urology. 152: 2031—5.
- ^ Ahlering, T. E.; Skarecky DW; McLaren, C. E.; Weinberg, A. C. (2002). „Seminal vesicle involvement in patients with D1 disease predicts early prostate specific antigen recurrence and metastasis after radical prostatectomy and early androgen ablation”. Cancer. 94 (6): 1648—53. PMID 11920524. doi:10.1002/cncr.10378.
- ^ Whitmore, Willet F. (1984). „Natural history and staging of prostate cancer”. Urol Clin North Am. 11 (2): 205—20. doi:10.1016/S0094-0143(21)00182-8.
- ^ Gnanapragasam, V. J.; Kumar, V; Langton, D.; Pickard, R. S.; Leung, H. Y. (2006). „Outcome of transurethral prostatectomy for the palliative management of lower urinary tract symptoms in men with prostate cancer”. International Journal of Urology. 13 (6): 711—5. PMID 16834648. doi:10.1111/j.1442-2042.2006.01391.x..
- ^ Krzakowski, Maciej; Potemski, Piotr; Warzocha, Krzysztof; Wysocki, Piotr J., ур. (2014). Onkologia kliniczna. T. 1. Gdańsk: VM Media VM Group. ISBN 978-83-7599-796-5.
- ^ Canto, E. I.; Shariat, S. F.; Slawin, K. M. (2003). „Biochemical staging of prostate cancer”. Urol Clin North Am. 30: 263—277.
- ^ Djavan BB, Remzi MM, Marberger MM. „When to biopsy and when to stop biopsying”. Urol Clin North Am. 30: 253—62. 2003..
- ^ а б Purohit RS, Shinohara K, Meng MV, Carroll PR. „Imaging clinically localized prostate cancer”. Urol Clin North Am. 30: 279—93. 2003..
- ^ Пурохит РС, Схинохара К, Менг MV, Царролл ПР. I„магинг цлиницаллy лоцализед простате цанцер”. Урол Цлин Нортх Ам. 30: 279—93. 2003.
- ^ Soulié M, Salomon L. Screening for prostate cancer: why, how?. Rev Prat. 63 469–71, 473, 475.
- ^ Gunning, J. E. (1974). „The history of laparoscopy”. J Reprod Med. 12: 222—6.
- ^ Heer, R; Raymond, I; Jackson, MJ; Soomro, NA (септембар 2011). „A critical systematic review of recent clinical trials comparing open retropubic, laparoscopic and robot-assisted laparoscopic radical prostatectomy”. Reviews on recent clinical trials. 6 (3): 241—9. PMID 21682688..
- ^ Huang, X; Wang, L; Zheng, X; Wang, X (март 2017). „Comparison of perioperative, functional, and oncologic outcomes between standard laparoscopic and robotic-assisted radical prostatectomy: a systemic review and meta-analysis”. Surgical endoscopy. 31 (3): 1045—1060..
- ^ Magheli A, Busch J, Leva N i sur. Comparison of surgical technique (open vs. laparoscopic). „on pathological and long term functional outcomes following radical prostatectomy”. BMC Urol. 14: 18. 2014..
- ^ Budäus L, Huland H, Graefen M (2012). „Controversies in the management of localized prostate cancer: Radical prostatectomy still the standard of care”. Crit Rev Oncol Hematol. 84: 24—9..
- ^ Bossi A (2008) Modern external-beam radiation therapy for prostate cancer: How and when? Eur Urol Suppl. 7: 22—8. Недостаје или је празан параметар
|title=(помоћ). - ^ Morris, D. E.; Emami, B; Manch PM i sur (2005). „Evidence-based review of threedimensional conformal radiotherapy for localized prostate cancer: an ASTRO outcomes initiative”. Int Radiat Oncol Biol Phys. 62: 3—19..
- ^ а б Crook, J. (2011). „The role of brachytherapy in the definitive management of prostate cancer”. Cancer Radioth. 15: 230—7..
- ^ Pasquier, D.; Ballereau, C. (2008). „Adjuvant and salvage radiotherapy after prostatectomy for prostate cancer: a literature review”. Int J Radiat Oncol Biol Phys. 72: 972—9..
Literatura
уреди- Marija Strnad Epidemiologija raka prostate, Medix • Studeni 2005 • Godinaa XI • Broj 60 / 61,
Spoljašnje veze
уреди- Video: Targeted Prostate Biopsy Using MR-Ultrasound Fusion (језик: енглески)
| Молимо Вас, обратите пажњу на важно упозорење у вези са темама из области медицине (здравља). |