Glioksilatni ciklus
Glioksilatni ciklus, varijacija ciklusa trikarboksilne kiseline, je anabolički put koji se javlja kod biljki, bakterija, protista, i gljiva. Glioksilatni ciklus je centriran na konverziji acetil-KoA u sukcinat radi sinteze ugljenih hidrata.[1] Kod mikroorganizama, glioksilatni ciklus omogućava ćelijama da koriste jednostavna ugljenična jedinjenja kao izvor ugljenika kad kompleksni izvori, kao što je glukoza nisu dostupni.[2] Generalno se smatralo da je ovaj ciklus odsutan kod životinja, izuzev nematoda u ranim stupnjevima embriogeneze. Zadnjih godina, međutim, detekcija malatne sintaze (MS) i izocitratne lijaze (ICL), ključnih enzima glioksilatnog ciklusa, u pojedinim životinjskim tkivima je podstakla pitanja vezana za evolucioni odnos enzima kod bakterija i životinja, i pretpostavlja se da životinje kodiraju alternativne enzime ciklusa sa različitom funkcijom od poznatih MS i ICL kod nemetazoanskih vrsta.[1][3]
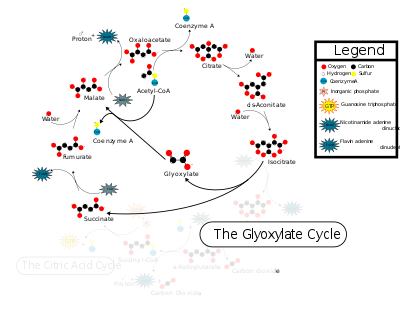
Sličnosti sa TCA ciklusom
уредиGlioksilatni ciklus koristi pet od osam enzima asociranih sa ciklusom trikarboksilne kiseline: citratna sintaza, akonitaza, sukcinatna dehidrogenaza, fumaraza, i malatna dehidrogenaza. Ova dva ciklusa se razlikuju po tome što se u glioksilatnom ciklusu, izocitrat konvertuje u glioksilat i sukcinat posredstvom ICL umesto u α-ketoglutarat.[1] Ovim se zaobilazi dekarboksilacioni korak koji je prisutan u TCA ciklusu, što omogućava da se jednostavna ugljenična jedinjenja koriste u kasnijim sintezama makromolekula, uključujući glukozu.[2] Glioksilat se naknadno kombinuje sa acetil-KoA i formira se malat, posredstvom MS.[1] Malat se isto tako formira paralelno iz sukcinata posredstvom sukcinatne dehidrogenaze i fumaraze.
Struktura intermedijera u Fišerovim projekcijama i poligonalnim modelima
уредиIntermedijeri glioksilatnog ciklusa prikazan u Fišerovim projekcijama prikazuju hemijske promene korak po korak. Takav prikaz se može porediti sa reprezentacijom poligonalnih modela.[4]
Reference
уреди- ^ а б в г Kondrashov, Fyodor A; Koonin, Eugene V.; Morgunov, I. G.; Finogenova, T. V.; Kondrashova, M. N.; et al. (23. 10. 2006). „Evolution of glyoxylate cycle enzymes in Metazoa: evidence of multiple horizontal transfer events and pseudogene formation”. Biology Direct. 1: 31. PMC 1630690 . PMID 17059607. doi:10.1186/1745-6150-1-31.
- ^ а б Lorenz, Michael; Fink, Gerald (oktobar 2002). „Life and Death in a Macrophage: Role of the Glyoxylate Cycle in Virulence”. Eukaryotic Cell. 1 (5): 657—662. PMC 126751 . PMID 12455685. doi:10.1128/EC.1.5.657-662.2002.
- ^ Popov, EA; Moskalev, EA; et al. (novembar 2005). „Comparative analysis of glyoxylate cycle key enzyme isocitrate lyase from organisms of different systematic groups”. Journal of Evolutionary Biochemistry and Physiology. 41 (6): 631—639. doi:10.1007/s10893-006-0004-3.
- ^ Bonafe, CFS; de Jesus MB; JAC, Bispo (2018), „The Polygonal Model: A Simple Representation of Biomolecules as a Tool for Teaching Metabolism”, Biochemistry and Molecular Biology Education, 46 (1): 66—75, doi:10.1002/bmb.21093