Интраутерина фетална хипоксија
Интраутерина фетална хипоксија је патолошко стање а не болест, које се јавља када фетуса, када он из одређених разлога (пролапс или оклузија пупчане врпце, плацентарни инфарк, пушење мајке, пренатална асфиксија итд) у свом организму нема довољну количину кисеоника. Интраутерина хипоксија, уколико дуже траје, може изазвати реверзибилно оштећење ћелија унутар централног нервног система (мозга и кичмене мождине), или резултовати повећаном стопом смртности, укључујући повећани ризик од синдрома изненадне смрти одојчади (СИДС). Снижен ниво кисеоника код фетуса и новорођенчета је један од битних чинилаца било као примарни или као доприноснећи фактор у бројним неуролошким и неуропсихијатријским поремећајима као што су епилепсија, поремећај хиперактивности са недостатком пажње, поремећаји у исхрани и церебрална парализа.[1][2][3][4][5]
| Интраутерина фетална хипоксија | |
|---|---|
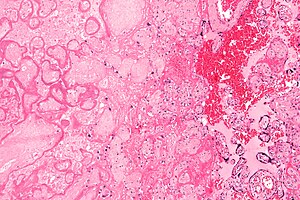 | |
| Патохистолошки препарат инфаркта плаценте (на слици лево), као узрок интраутерине хипоксије. |
Епидемиологија
уредиЕмбриогенеза, раст фетуса и његово преживљавање у перинаталном периоду зависи од оптималног здравља мајке и од нормалног развој плаценте. Излагање мајке упорном хипоксичном окружењу може довести до критичних оштећења виталних органа фетуса. Неуспех нормалне функције плаценте може имати сложене акутне и хронични ефекте не само на развој фетуса и интраутерине поремећаја раста, већ и на појаве асфиксије и других вишеструких поремећаја попут прераног периода порођаја и перинаталне смрти.
И поред тог што је савремена медицина довољно добро проучила патологију феталне хипоксије, и тако постала способна да је правовремено идентификује и елиминише епидемиолошки гледано број случајева из ове патологије (са више од 10% свих трудноћа и порођаја), у исто време не опада, већ супротно очекивањима расте, и постаје један је од главних узрока морбидитета и морталитета у нерођених беба и/или новорођенчади у првој недељи живота.[6]
Примера ради, у САД, интраутерини поремећај раста и прематурне комплиције јављају се у око 12% трудноћа и представља главни узрок перинатални морталитет и морбидитет који до данашњих дана чини до 75% перинаталних смрти.[7]
Дугорочно гледано интраутерина фетална хипоксија, за собом оставља и бројне органске последице, као што су церебрална парализа, губитак слуха, ретинопатије и хронична плућа болест, што је директно повезано са значајним емоционалним оптерећењем угрожених породица са оваквом децом и великим трошкове здравствене заштите како за појединца тако и за друштво у целини.[7]
Етиопатогенеза
уредиНа почетку ембрионалног развоја фетуса, хипоксија не игра главну улогу, јер у раном развоју структуралних срчаних малформација вероватно због тога што се у раном развојном периоду ембриогенеза овај процес ионако одвија у анаеробним условима. Тек од другог и трећег триместра, кисеоник постаје важан чинилац за нормалну феталну органогенезу и даљи раст фетуса. Ако се у тој фази фетус изложи акутној хипоксији, он у циљу заштите он још има бројне заштитне механизме:
- Непосредну заштиту од оксидативног стреса успостављеном регулацијом гена.[8]
- Стимулацију синтезе азот оксида, која побољшава ћелијску сигнализацији за покретање механизме одбране, затим настаје инхибиција тромбоцита и регулација апоптозе.
- β2AR and Gsα регулишу и одржају довољан кардиолошки учинак.
Међутим код перзистентне (хроничне) хипоксије долази до прераног изласка организма фетуса из нормалног ћелијског циклуса, што доводи до појачане апоптозе (која је мање изражена), и хипертрофије кардиомиоцита. Иако овај процес има за циљ да створи бољу енергетску ефикасност током хипоксичних услова он такође резултује мањом величином срчаних комора.[9] Измењена регулација изазвана хипоксијом, потом доводи до појаве експресија гена, као одговор на интраутерину хипоксију, каја се даље наставља у зрело доба и опонаша промене код одраслих са хроничном срчаном инсуфицијенцијом.
У даљем току развоја трудноће хипоксија успорава раст фетуса, а рестрикција раста се сада сматра фактором ризика од превремене артеријске хипертензије и кардиоваскуларне болести, вероватно секундарног порекла у односу на ендотелне дисфункције.
Етиолошки фактори
уредиЗа настанак интраутерине феталне хипоксије као најзначајнији етиолошки фактори наводе се директни и индиректни чиниоци:
Директни чиниоци — су непосредно повезани са трудноћом, прате недостатак кисеоника у организму фетуса и новорођенчади, и узрокује изузетно велики број компликација током трудноће и порођаја
Индиректни чиниоци — у које спадају бројни узроци који нису директно повезани са трудноћом.
Сви узроци који могу довести до антенаталне, интранаталне и перинаталне хипоксију фетуса могу се поделити у пет група.
| Група поремећаја | Патологија | Етиолошки чиниоци |
|---|---|---|
| Прва | Плацентална патологија | Аномалије развоја, плаценте превија и плацентелна абрупција, трауме, хеморагија, тумори, инфекције плаценте. |
| Друга | Патологија пупчане врпце | Развојне аномалије, торзија пупчане врпце, прави чвор пупчане врпце. |
| Трећа | феталне патологије | Сензитизација резус фактора, интраутерина ретардација раста, интраутерине инфекције, малформације фетуса, генетске болести. |
| Четврта | Компликован ток трудноће и порођаја | Највећи удео у овој групи чини гестоза и дуготрајна опасност од абортуса. Остали, не мање важни узроци обухватају: анемију током трудноће, нефропатију, антифосфолипидном синдром, интраутерине инфекције, полихидрамнион и олигохидрамнион, вишесгтруку трудноћу, превремени порођај, дисфункцију материце, продужену трудноћу. |
| Пета | Хроничних поремећаја у трудноћи | Најћешча стања у овој групи су: кардиоваскуларне промене (реуматизам, болести срца, цардиопсицхонеуросис), ендокриних (дијабетеса, болести штитасте жлезде, гојазност), хроничне болести бубрега, плућа, јетре, крви, карцином, наркоманија, алкохолизам. |
Сви наведени узроци доводе и до матерично — постељичне инсуфицијенције, главног фактора у развоју хроничне хипоксије, која у неким случајевима може бити последица утицаја нпр. егзогених чинилаца који се јављају у условима ниског парцијалног притиска кисеоника у удахнутогм ваздуху (висинска подручја, далеко на северу света, итд).
Облици интраутерине хипоксије
уредиКако је нтраутерина хипоксија повезана са разним стањима мајчине плаценте и стањем самог фетуса што се може манифестовати другачије и имати различите исходе. Кингдом и Кауфман су [29]ради лакшег сагледавања овог поремећаја предложили следећу класификују, или 3 подтипа хипоксичних стања у трудноћи
| Потип хипоксије | Главне карактеристике |
|---|---|
| Преплацентна хипоксија |
|
| Утероплацентна хипоксија |
|
| Постплацентна хипоксија |
|
Облици интраутерине хипоксије према трајању
уредиАкутна хипоксија плода
уредиУзроци акутне хипоксије плода који изазивају брзи прекид дотока кисеоника у тело могу бити:
- пролапс пупчанника,
- чврсто уплитање пупчане врпце око врата фетуса,
- чврсто увртање пупчане врпце око своје осе,
- акутно крварење материце,
- плацента праевија и превремено одвајање постељице током порођаја,
- абнормални положај плода,
- превремени порођај, итд .
Хронична хипоксија плода
уредиОвај одељак би требало проширити. Можете помоћи додавањем садржаја. |
Извори
уреди- ^ Maslova, MV; Maklakova, AS; Sokolova, NA; Ashmarin, IP; Goncharenko, EN; Krushinskaya, YV (2003). „The effects of ante- and postnatal hypoxia on the central nervous system and their correction with peptide hormones”. Neuroscience and Behavioral Physiology. 33 (6): 607—11. PMID 14552554. doi:10.1023/A:1023938905744.
- ^ Bulterys, MG; Greenland, S; Kraus, JF (1990). „Chronic fetal hypoxia and sudden infant death syndrome: interaction between maternal smoking and low hematocrit during pregnancy”. Pediatrics. 86 (4): 535—40. PMID 2216618.
- ^ Peleg, D; Kennedy, CM; Hunter, SK (1998). „Intrauterine growth restriction: identification and management”. American Family Physician. 58 (2): 453—60, 466—7. PMID 9713399.
- ^ Rosenberg, A (2008). „The IUGR newborn”. Seminars in Perinatology. 32 (3): 219—24. PMID 18482625. doi:10.1053/j.semperi.2007.11.003.
- ^ Gonzalez, FF; Miller, SP (2006). „Does perinatal asphyxia impair cognitive function without cerebral palsy?”. Archives of Disease in Childhood: Fetal and Neonatal Edition. 91 (6): F454—9. PMC 2672766 . PMID 17056843. doi:10.1136/adc.2005.092445.
- ^ Habek, D; Habek, JC; Jugović, D; Salihagić, A (2002). „Intrauterine hypoxia and sudden infant death syndrome”. Acta Medica Croatica : Casopis Hravatske Akademije Medicinskih Znanosti. 56 (3): 109—18. PMID 12630342.
- ^ а б C. V. Ananth and A. M. Vintzileos, “Epidemiology of preterm birth and its clinical subtypes,” Journal of Maternal-Fetal and Neonatal Medicine, vol. 19, no. 12, pp. 773–782, 2006.
- ^ H. M. Beere and D. R. Green, “Stress management—heat shock protein-70 and the regulation of apoptosis,” Trends in Cell Biology, vol. 11, no. 1, pp. 6–10, 2001.
- ^ J. Jayakumar, K. Suzuki, I. A. Sammut et al., “Heat shock protein 70 gene transfection protects mitochondrial and ventricular function against ischemia-reperfusion injury,” Circulation, vol. 104, no. 12, supplement 1, pp. i303–i307,2001.
- ^ D. J. P. Barker, A. R. Bull, C. Osmond, and S. J. Simmonds, “Fetal and placental size and risk of hypertension in adult life,” British Medical Journal, vol. 301, no. 6746, pp. 259–262, 1990
- ^ J. E. Ramsay, F. Stewart, I. A. Greer, and N. Sattar, “Microvascular dysfunction: a link between pre-eclampsia and maternal coronary heart disease,” BJOG, vol. 110, no. 11, pp. 1029–1031, 2003.
- ^ B. J. Wilson, M. S. Watson, G. J. Prescott et al., “Hypertensive diseases of pregnancy and risk of hypertension and stroke in later life: results from cohort study,” British Medical Journal, vol. 326, no. 7394, pp. 845–849, 2003.
- ^ L. Haukkamaa, M. Salminen, H. Laivuori, H. Leinonen, V. Hiilesmaa, and R. Kaaja, “Risk for subsequent coronary artery disease after preeclampsia,” American Journal of Cardiology, vol. 93, no. 6, pp. 805–808, 2004.
- ^ D. J. P. Barker, “Growth in utero and coronary heart disease,” Nutrition Reviews, vol. 54, no. 2, pp. S1–S7, 1996. D. J. P. Barker, C. Osmond, J. Golding, D. Kuh, and M. E. J. Wadsworth, “Growth in utero, blood pressure in childhood and adult life, and mortality from cardiovascular disease,” British Medical Journal, vol. 298, no. 6673, pp. 564–567, 1989.
- ^ D. J. P. Barker, A. W. Shiell, M. E. Barker, and C. M. Law, “Growth in utero and blood pressure levels in the next generation,” Journal of Hypertension, vol. 18, no. 7, pp. 843–846, 2000.
- ^ E. A. Herrera, V. M. Pulgar, R. A. Riquelme et al., “Highaltitude chronic hypoxia during gestation and after birth modifies cardiovascular responses in newborn sheep,” American Journal of Physiology, vol. 292, no. 6, pp. R2234–R2240, 2007.
- ^ C. N. Martyn, D. J. P. Barker, S. Jespersen, S. Greenwald, C. Osmond, and C. Berry, “Growth in utero, adult blood pressure, and arterial compliance,” British Heart Journal, vol. 73, no. 2, pp. 116–121, 1995.
- ^ C. Sartori, Y. Allemann, L. Trueb, A. Delabays, P. Nicod, and U. Scherrer, “Augmented vasoreactivity in adult life associated with perinatal vascular insult,” The Lancet, vol. 353, no. 9171, pp. 2205–2207, 1999.
- ^ R. B. Ness and B. M. Sibai, “Shared and disparate components of the pathophysiologies of fetal growth restriction and preeclampsia,” American Journal of Obstetrics and Gynecology, vol. 195, no. 1, pp. 40–49, 2006.
- ^ J. G. Ray, M. J. Vermeulen, M. J. Schull, and D. A. Redelmeier, “Cardiovascular health after maternal placental syndromes (CHAMPS): population-based retrospective cohort study,” The Lancet, vol. 366, no. 9499, pp. 1797–1803, 2005
- ^ A. Y. Lausman, J. C. Kingdom, T. J. Bradley, C. Slorach, and J. G. Ray, “Subclinical atherosclerosis in association with elevated placental vascular resistance in early pregnancy,” Atherosclerosis, vol. 206, no. 1, pp. 33–35, 2009.
Спољашње везе
уреди| Класификација |
|---|
| Молимо Вас, обратите пажњу на важно упозорење у вези са темама из области медицине (здравља). |