Хетерогена катализа
Хетерогена катализа је тип катализe где се фаза катализатора разликује од фазе реактаната, за разлику од хомогене катализе где су реактант и катализатор у истој фази.[1] Фаза означава не само чврсте, течне и гасне компоненте, већ и немешљиве течности (нпр. уље и вода), или било где где постоји фазна граница. Катализатори су корисни јер убрзавају хемијску реакцију[2], али се у току реакције њихова концентрација не мења и стога се могу користити изнова и изнова.
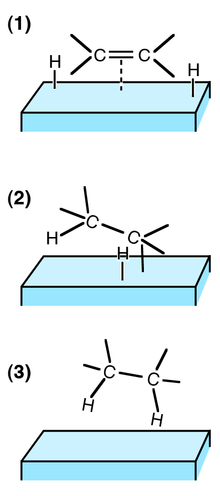
Хетерогена катализа обично подразумева катализатор чврсте фазе и реактант гасне фазе. Тада постоји циклус молекуларне адсорпције, реакције и десорпције који се јавља на површини.[3] Термодинамика, пренос масе и пренос топлоте током ових појава утичу на брзину (кинетику) реакције.
Хетерогена катализа је веома важна јер омогућава бржу, већу производњу и селективно формирање производа.[4] Хетерогена катализа доприноси око 35% светског БДП-а.
Adsorpcija уреди
Адсорпција је битан корак у хетерогеној катализи. Адсорпција је процес којим се молекули фазе гаса (или раствора) (адсорбат) везују за чврсте (или течне) атоме површине (адсорбент). Обрнут процес од адсорпције је десорпција, где се адсорбат раздваја од адсорбента. У реакцији хетерогене катализе, катализатор је адсорбент и реактанти су адсорбат.
Врсте адсорпције уреди
Постоје две врсте адсорпције: физисорпција (слабо везана), хемисорпција (снажно везана). Многи процеси у хетерогеној катализи леже између та два екстрема.[5]
Физисорпција уреди
Код физисопрције, молекул је привучен ка површинским атомима преко ван дер Ваалсових сила. То укључује дипол-дипол интеракције, индуковани дипол-дипол интеракције и Лондонове дисперзионе силе. Између адсорбата и адсорбента не настају хемијске везе, а њихова електронска стања остају релативно непромењена. Типичне енергије физисорпције су од 3 до 10 kcal/mol.[6] У хетерогеној катализи, када се реактант молекула физисорбује на катализатор, обично се каже да је у стању прекурсора, тј. у неком средњем енергетском стању пре хемисорпције.[5] Из стања прекурсора, молекул може или да се хемисорбује, десорбује или мигрира преко површине.[7]
Хемисорпција уреди
Када се молекул приближи довољно близу површинским атомима тако да се њихови електронски облаци преклапају, може доћи до хемисорпције. У хемисорпцији, адсорбат и адсорбент деле електроне, па долази до формирања хемијских веза. Типичне енергије хемисорпције су од 20 до 100 kcal/mol.[8] Два облика хемисорпције су:
- Молекуларна адсорпција: адсорбат остаје нетакнут. Пример је везивање алкена помоћу платине.
- Дисоцијативна адсорпција: долази до пуцања једне или бише хемијских веза. У овом случају, енергија дисоцијације утиче на брзину адсорпције. Пример за ово је везивање H2 за метални катализатор, где H-H веза пуца после адсорпције.
Реакције на површини уреди
Реакције на површини се могу описати са два различита механизма.[8]
- Лангмир-Хиншелвудов механизам: Реактантни молекули, А и B, се обоје адсорбују на каталитичку површину. Када се адсорбују долази до хемијске реакције која даје продукт C, који се затим десорбује са површине катализатора.
- Ели-Рајдлов механизам: Реактант А се адсорбује на каталитичку површину. Без адсорпције, B реагује са апсорбованим А и формира C, који затим десорбује са површине катализатора.
Већина хетерогено катализованих реакција се дешава преко Лангмир-Хиншелвудовог механизма.[9]
У хетерогеној катализи, реактанти дифундују из течне фазе да би се адсорбовали на површину катализатора. Место адсорпције није увек активно место катализатора, тако да молекули реактаната морају да мигрирају преко површине до активног места. На активном месту, молекули реактаната реагују формирајући молекул производа, пратећи енергетски лакши пут кроз каталитичке интермедијере. Молекули производа се затим десорбују са површине и распршују. Сам катализатор остаје нетакнут и слободан је да посредује у даљим реакцијама.
Дизајн катализатора уреди
Катализатори нису активни за реактанте на целој својој површини; само специфичне локације имају каталитичку активност, па се називају активна места. Површина чврстог катализатора има значајан утицај на број расположивих активних места. У индустријској пракси, чврсти катализатори су често порозни да би се повећала површина, обично постижући 50–400 m²/g.[8] Порозни материјали су исплативи због доброг односа површине и масе и повећане каталитичке активности.
Често су чврсти катализатори дисперговани на носећем материјалу да би се повећала површина (проширио број активних места) и обезбедила стабилност.[8] Обично су ови носачи инертни материјали високе тачке топљења, али и сами могу бити катализатори. Порозни носачи морају бити пажљиво изабрани тако да реактанти и производи могу да уђу и изађу из материјала.
Сабатјеов принцип се може сматрати једним од темеља модерне теорије катализе.[10] Он каже да интеракција површинских адсорбата мора бити оптимална: не сувише слаба (да би могла да веже реактанте) и не превише јака (да не би затрпала површину и спречила десорпцију производа). Ова тврдња да интеракција површине и адсорбата мора бити оптимална је квалитативна. Обично је број адсорбата и прелазних стања повезаних са хемијском реакцијом велик, тако да се оптимум мора наћи у вишедимензионалном простору. Дизајн катализатора у тако великом димензионалном простору није рачунски одржив задатак.[11]
Деактивација катализатора уреди
Деактивација катализатора се дефинише као губитак каталитичке активности и/или селективности током времена.
Супстанце које смањују брзину реакције се називају каталитичим отровима. Отрови се хемисорбирају на површину катализатора и смањују број расположивих активних места.[12] Уобичајени отрови су елементи из V, VI и VII групе (нпр. S, O, P, Cl), неки токсични метали (нпр. As, Pb) и адсорбујуће врсте са вишеструким везама (нпр. CO, незасићени угљоводоници).[5] На пример, сумпор прекида производњу метанола тровањем катализатора Cu/ZnO.[13] Супстанце које повећавају брзину реакције називају се промотори. На пример, присуство алкалних метала у синтези амонијака повећава брзину дисоцијације H2.[13]
Присуство отрова и промотора може променити енергију активације спорог ступња реакције и утицати на селективност катализатора за формирање одређених производа. У зависности од количине, супстанца може бити повољна или неповољна за хемијски процес. На пример, у производњи етилена, мала количина хемисорбованог хлора ће деловати као промотор побољшањем селективности Ag-катализатора према етилену у односу на CO2, док ће превише хлора деловати као отров.[5]
Неке појаве које доприносе деактивацији катализатора су:
- Синтерирање: при загревању, распршене честице каталитичких метала могу да мигрирају преко површине подлоге и формирају кристале. Ово доводи до смањења корисне површине катализатора.
- Таложење материјала из течне фазе на чврсту фазе катализатора и/или носача. Ово доводи до блокирања активног места и/или пора.
- Коксирање: таложење чврстих, тешких материја, богатих угљеником, на површини катализатора услед разлагања угљоводоника.[12]
- Реакције гас-чврсто: формирање неактивног површинског слоја и/или формирање лако испарљивог једињења које излази из реактора.[12] Ово доводи до губитка површине и/или дела самог катализатора.
- Промена чврстог стања: дифузија атома носача катализатора на површину праћена реакцијом која формира неактивну фазу. Ово доводи до губитка површине катализатора.
- Ерозија: континуирано истискивање материјала катализатора, уобичајеног у реакторима са флуидизованим слојем.[14] Ово доводи до губитка дела катализатора.
Индустријски примери уреди
При примени хетерогених катализатопа у индустрији мора се узети у обзир дизајн хемијског реактора, као и многе експерименталне варијабле. Уобичајени реактори хетерогене катализе укључују реакторе шаржног, континуираног и флуидизованог слоја, док новији уређаји укључују фиксне, микроканалне и мултифункционалне реакторе.[5] На реакцију могу утицати димензије реактора, површина катализатора, тип катализатора, носач, као и радни услови реактора као што су температура, притисак и концентрације реактанта.
Овде ћемо навести само неколико најчешћих индустријских процеса који користе хетерогену катализу:[15]
| Процес | Реактанти, Продукти | Катализатор | Коментар |
|---|---|---|---|
| Синтеза сулфатне киселине | SO2 + O2, SO3 | оксиди ванадијума | Хидратација SO3 дајe сулфатну киселину |
| Синтеза амонијака | N2 + H2, NH3 | оксиди гвожђа на Аl2O3 | Троши 1% светске електричне енергије[6] |
| Синтеза етилен-оксида | C2H4 + O2, C2H4O | сребро на Аl2O3 | Лоша применљливост на друге алкене |
Референце уреди
- ^ Schlögl, Robert (09. 03. 2015). "Heterogeneous Catalysis". Angewandte Chemie International Edition.
- ^ "IUPAC Gold Book - catalyst". International Union of Pure and Applied Chemistry.
- ^ Nedić Vasiljević, Bojana; Milojević-Rakić, Maja; Jović, Aleksandar (2015). Praktikum i zadaci iz hemijske kinetike. Beograd: Univerzitet u Beogradu - Fakultet za fizičku hemiju. ISBN 978-86-82139-56-0.
- ^ Information, Lawrence Berkeley National Laboratory. The impact of nanoscience on heterogeneous catalysis. United States: United States. Department of Energy. Office of Scientific and Technical (2003.
- ^ а б в г д Thomas, J. M. (John Meurig). Principles and practice of heterogeneous catalysis. Thomas, W. J. (2. revised изд.). Weinheim, Germany. ISBN 9783527683789. OCLC 898421752.
- ^ а б Rothenberg, Gadi. (2008). Catalysis : concepts and green applications. Weinheim [Germany]: Wiley-VCH. ISBN 9783527318247. OCLC 213106542.
- ^ Bowker, Michael (6. 5. 2016). „The Role of Precursor States in Adsorption, Surface Reactions and Catalysis”. Topics in Catalysis (на језику: енглески). 59 (8-9): 663—670. ISSN 1022-5528. doi:10.1007/s11244-016-0538-6.
- ^ а б в г Rothenberg, Gadi. (7. 5. 2008). Catalysis : concepts and green applications. Weinheim [Germany]: Wiley-VCH. ISBN 9783527318247. OCLC 213106542.
- ^ Petukhov, A.V. (25. 10. 1997). „Effect of molecular mobility on kinetics of an electrochemical Langmuir-Hinshelwood reaction”. Chemical Physics Letters (на језику: енглески). 277 (5-6): 539—544. doi:10.1016/S0009-2614(97)00916-0.
- ^ Medford, Andrew J.; Vojvodic, Aleksandra; Hummelshøj, Jens S.; Voss, Johannes; Abild-Pedersen, Frank; Studt, Felix; Bligaard, Thomas; Nilsson, Anders; Nørskov, Jens K. (01. 08. 2015). „From the Sabatier principle to a predictive theory of transition-metal heterogeneous catalysis”. Journal of Catalysis. Special Issue: The Impact of Haldor Topsøe on Catalysis. 328: 36—42. ISSN 0021-9517. doi:10.1016/j.jcat.2014.12.033.
- ^ Abild-Pedersen, F.; Greeley, J.; Studt, F.; Rossmeisl, J.; Munter, T. R.; Moses, P. G.; Skúlason, E.; Bligaard, T.; Nørskov, J. K. (06. 07. 2007). „Scaling Properties of Adsorption Energies for Hydrogen-Containing Molecules on Transition-Metal Surfaces”. Physical Review Letters (на језику: енглески). 99 (1). ISSN 0031-9007. doi:10.1103/PhysRevLett.99.016105.
- ^ а б в Bartholomew, Calvin H (2001-4). „Mechanisms of catalyst deactivation”. Applied Catalysis A: General (на језику: енглески). 212 (1-2): 17—60. doi:10.1016/S0926-860X(00)00843-7. Проверите вредност парамет(а)ра за датум:
|date=(помоћ) - ^ а б Nørskov, Jens K. Fundamental concepts in heterogeneous catalysis. Studt, Felix., Abild-Pedersen, Frank., Bligaard, Thomas. Hoboken, New Jersey. ISBN 9781118892022. OCLC 884500509.
- ^ Forzatti, P (14. 09. 1999). „Catalyst deactivation”. Catalysis Today. 52 (2-3): 165—181. doi:10.1016/S0920-5861(99)00074-7.
- ^ Encyclopedia of inorganic chemistry. King, R. Bruce. (2. изд.). Chichester, West Sussex, England: Wiley. 1. 6. 2006, ©2005. ISBN 9780470860786. OCLC 60348994. Проверите вредност парамет(а)ра за датум:
|date=(помоћ)
Литература уреди
- Nedić Vasiljević, Bojana; Milojević-Rakić, Maja; Jović, Aleksandar (2015). Praktikum i zadaci iz hemijske kinetike. Beograd: Univerzitet u Beogradu - Fakultet za fizičku hemiju
- Thomas, J.M. (John Meuring), Principles and practice of heterogeneous catalysis (Second edition). Weinheim,Germany.