Молекулска орбитала
У хемији, молекулска орбитала (скр. МО) је математичка функција која описује понашање електрона као таласа у молекулу.[1][2][3] Ова функција се може користити за израчунавање физичких и хемијских особина као што је налажење електрона у одређеном делу простора. Молекулске орбитале се најчешће конструишу комбинацијом атомских или хибридних орбитала сваког од атома у датом молекулу.[4][5] Термине атомска орбитала и молекуларна орбитала[а] увео је Роберт С. Маликен 1932. да означавају једноелектронске орбиталне таласне функције.[7] На елементарном нивоу, они се користе за описивање области простора у којој функција има значајну амплитуду.
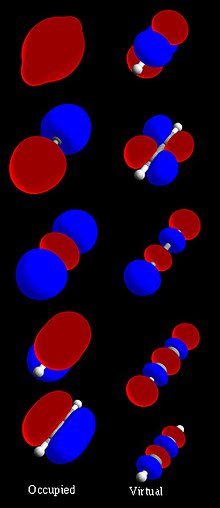
На елементарном нивоу, молекулска орбитала се користи за описивање простора у коме функција има значајну амплитуду. У изолованом атому локација орбиталних електрона одређена је функцијама које се називају атомске орбитале. Када се више атома хемијски комбинује у молекул, локације електрона одређују молекул у целини, тако да се атомске орбитале комбинују и формирају молекуларне орбитале. Електрони из саставних атома заузимају молекуларне орбитале. Математички, молекуларне орбитале су приближно решење Шредингерове једначине за електроне у пољу атомских језгара молекула. Оне се обично граде комбинујући атомске орбитале или хибридне орбитале из сваког атома молекула или друге молекуларне орбитале из група атома. Оне се могу квантитативно израчунати помоћу Хартри-Фокововог или метода самоконзистентних поља (SCF).
Преглед
уредиМолекулска орбитала може да послужи за одређивање електронске конфигурације молекула: просторне дистрибуције и енергије електрона или пара електрона. Најчешће се молекулске орбитале приказују као линеарна комбинација атомских орбитала, нарочито при квалитативној или приближној анализи. Овај метод је незамјенљив за обезбјеђивање једноставног модела веза у молекулу, као што је случај са теоријом молекулских орбитала.[9]
Молекулска орбитала описује понашање једног електрона у електричном пољу које ствара језгро и просјечна расподјела других електрона. Ако се у орбитали налазе два електрона Паулијев принцип искључења налаже да морају имати супротан спин. Молекулска орбитала представља апроксимацију и описи таласне функције електрона у молекулу који су високо тачни немају орбитале.
Квалитативни опис
уредиСве таласно механичке односно таласно механичке законитости које важе за атом, важе и за сложенији систем — молекул. То значи да су према овој теорији и методи електрони распоређени у молекулу као и у атому по одговарајућим орбиталама. Основна разлика је што су атомске орбитале моноцентричне, а молекулске су полицентричне тј. изграђују се око два или више атомских језгара.
Молекулске орбитале се могу добити методом линеарне комбинације атомских орбитала. Као резултат комбинације двије атомске орбитале, добијају се двије молекулске орбитале представљене збиром односно разликом атомских орбитала. Број молекулских орбитала које настају је једнак броју атомских орбитала које су укључене у линеарну комбинацију.[10]
При грађењу молекулске орбитале, у односу на атомску орбиталу долази до слиједећих промијена:
- губи се централна симетрија Кулоновског потенцијала (квантни број l више није добар квантни број за опис)
- електрони су истовремено придружени на оба атома
- долази до цијепања дегенерисаних енергетских нивоа
Линеарне комбинације атомских орбитала (LCAO)
уредиМолекуларне орбитале су први увели Фридрих Хунд[11][12] и Роберт С. Муликен[13][14] 1927. и 1928. године.[15][16] Линеарну комбинацију атомских орбитала или „LCAO” апроксимацију за молекуларне орбитале увео је 1929. године Џон Ленард-Џоунс.[17] Његов револуционарни рад показао је како се из квантних принципа може извести електронска структура молекула флуора и кисеоника. Овај квалитативни приступ молекуларно орбиталној теорији је део почетка модерне квантне хемије.
Линеарне комбинације атомских орбитала (LCAO) могу се користити за процену молекулских орбитала које настају везањем између саставних атома молекула. Слично атомској орбитали, Шредингерова једначина која описује понашање електрона такође се може конструисати за молекуларну орбиталу. Линеарне комбинације атомских орбитала, или збирови и разлике атомских таласних функција пружају приближна решења Хартри-Фокових једначина која одговарају апроксимацији независних честица молекуларне Шредингерове једначине. За једноставне дијатомске молекуле добијене таласне функције су математички представљене једначинама
где су и молекуларне таласне функције за везујуће и антивезујуће молекуларне орбитале, и су атомске таласне функције од атома а и б, а и су подесиви коефицијенти. Ови коефицијенти могу бити позитивни или негативни, зависно од енергије и симетрије појединих атомских орбитала. Како се два атома зближавају, њихове атомске орбитале се преклапају да би створиле подручја високе густине електрона, и као последица тога између два атома се формирају молекуларне орбитале. Атоми се држе заједно помоћу електростатичке привлачности између позитивно наелектрисаних језгара и негативно наелектрисаних електрона који заузимају везујуће молекуларне орбитале.<ref name="Gary L. Miessler 2004">
Номенклатура молекулских орбитала
уредиПри запису молекулских орбитала наводи се[18]:
- атомске орбитале од којих потиче молекулска
- број чворних равни (број нодалних равни или равни симетрије) преко квантног броја λ
- да ли је орбитала везујућа или развезујућа
- симетрија орбитала (гераде g (од немачке речи за парно gerade) или унгераде u (непарно), у зависности од тога да ли је у односу на инверзију на центар симетрије орбитала парна или непарна)
Примјери
уредиH2
уредиМолекул водоника се састоји од два атома водоника које означавамо са H' и H". Линеарном комбинацијом 1s' и 1s" атомских орбитала добијају се двије молекулске орбитале: једна везивна и друга антивезивна. Везивна молекулска орбитала се добије сабирањем атомских орбитала и одговара стању система у коме се електрон налази у везивној области. Антивезивна молекулска орбитала се односи на одузимање атомских орбитала и одговара стању система у коме се електрон налази у антивезивној области.
Везивна орбитала је по енергији нижа од атомских орбитала, док антивезивна орбитала има већу енергију.
Изградњу молекула од атома можемо описати прераспоређивањем електрона из атомских у молекулске орбитале.
У молекулу водоника имају два електрона при чему оба електрона се распоређују у везивну орбиталу при чему систем постаје нижи у енергији. При томе је направљена ковалентна веза.
Ред везе се дефинише као број електрона у везивним орбиталама минус број електрона у антивезивним орбиталама и све подијељено са два. У примјеру молекула водоника имају два електрона у везивној орбитали у нема електрона у антивезивним орбиталама, па је ред везе један и постоји једна веза између атома водоника.
He2
уредиХелијум има два електрона у 1s орбитали у основном стању. У случају хипотетичког молекула He2, два електрона би попунила везивну орбиталу а два антивезивну и резултујућа електронска густина не подржава формирање везе између атома и молекул не постоји. Ред везе је нула и веза не постоји.
Да би могла да се успостави хемијска веза тј. награди молекул једињења потребно је да број електрона у везивним орбиталама буде већи него у антивезивним.
Молекул HeH би имао мало мању енергију него почетни атоми, али већу енергетску предност тј. мању енергију има H2 + 2 He, тако да молекул HeH постоји само кратко.
Енергетски дијаграми
уредиУ случају сложенијих молекула, таласно механички модел је погодан за квантитивни опис веза, али не и за квалитативни. Због тога се уводе енергетски дијаграми у којима се молекулске орбитале представљене хоризонталним линијама, при чему орбитале које имају вишу енергију су нацртане више. Дегенерисане орбитале (орбитале са истом енергијом) су представљене на истом нивоу, али се између њих налази размак. Електрони се попуњавају један по један придржавајући се Паулијевог принципа искључења и Хундовог правила тј. у једној орбитали се налазе максимално два електрона супротног спина, на истом енергетском нивоу електрони се попуњавају да има максималан број неспарених електрона а затим се упарују.
HOMO и LUMO орбитале
уредиНајвиша попуњена молекулска орбитала се назива HOMO, а најнижа молекулска орбитала која није попуњена се назива LUMO. Разлика између енергија HOMO и LUMO молекулских орбитала се назива забрањена зона и може да служи као мјера за способност побуђивања молекула, што је мања енергија то је молекул лакше побудити.
Види још
уредиНапомене
уредиРеференце
уреди- ^ Peter Atkins; Julio De Paula. Atkins’ Physical Chemistry. Oxford University Press. 8th ed., 2006.}-
- ^ Yves Jean; Francois Volatron. An Introduction to Molecular Orbitals. Oxford University Press, 1993.
- ^ Munowitz 2000, стр. 229–233
- ^ Gary L. Miessler; Donald A. Tarr. Inorganic Chemistry. Pearson Prentice Hall, 3rd ed., 2004.
- ^ Mulliken, Robert S. (јул 1932). „Electronic Structures of Polyatomic Molecules and Valence. II. General Considerations”. Physical Review. 41 (1): 49—71. Bibcode:1932PhRv...41...49M. doi:10.1103/PhysRev.41.49.
- ^ orbital. Dictionary by Merriam-Webster: America's most-trusted online dictionary. Merriam-Webster. Приступљено 18. 4. 2021.
- ^ а б Mulliken, Robert S. (јул 1932). „Electronic Structures of Polyatomic Molecules and Valence. II. General Considerations”. Physical Review. 41 (1): 49—71. Bibcode:1932PhRv...41...49M. doi:10.1103/PhysRev.41.49.
- ^ Brown, Theodore (2002). Chemistry : the central science. Upper Saddle River, NJ: Prentice Hall. ISBN 0-13-066997-0.
- ^ Catherine E. Housecroft, Alan G, Sharpe, Inorganic Chemistry, Pearson Prentice Hall; 2nd Edition, (2005). pp. 29–33.
- ^ Albright, T. A.; Burdett, J. K.; Whangbo, M.-H. (2013). Orbital Interactions in Chemistry. Hoboken, N.J.: Wiley. ISBN 9780471080398.
- ^ F. Hund, "Zur Deutung einiger Erscheinungen in den Molekelspektren" [On the interpretation of some phenomena in molecular spectra] Zeitschrift für Physik, vol. 36, pages 657-674 (1926).
- ^ F. Hund, "Zur Deutung der Molekelspektren", Zeitschrift für Physik, Part I, vol. 40, pages 742-764 (1927); Part II, vol. 42, pages 93–120 (1927); Part III, vol. 43, pages 805-826 (1927); Part IV, vol. 51, pages 759-795 (1928); Part V, vol. 63, pages 719-751 (1930).
- ^ R. S. Mulliken, "Electronic states. IV. Hund's theory; second positive nitrogen and Swan bands; alternate intensities", Physical Review, vol. 29, pages 637–649 (1927).
- ^ R. S. Mulliken, "The assignment of quantum numbers for electrons in molecules", Physical Review, vol. 32, pages 186–222 (1928).
- ^ Friedrich Hund and Chemistry, Werner Kutzelnigg, on the occasion of Hund's 100th birthday, Angewandte Chemie International Edition, 35, 573–586, (1996)
- ^ Robert S. Mulliken's Nobel Lecture, Science, 157, no. 3785, 13-24. Available on-line at: Nobelprize.org
- ^ Sir John Lennard-Jones, "The electronic structure of some diatomic molecules", Transactions of the Faraday Society, vol. 25, pages 668-686 (1929).
- ^ Белић 2000, стр. 101.
Литература
уреди- Munowitz, Michael (2000). Principles of Chemistry. Norton & Company. стр. 229-233.
- Белић, Драгољуб (2000). Физика молекула. Београд. стр. 101.
- Cohen-Tannoudji, Claude; Diu, Bernard; Laloë, Franck. Quantum Mechanics. 1. Hermann. ISBN 9782705683924.
- Shankar, Ramamurti (2013). Principles of Quantum Mechanics. Springer. ISBN 9781461576754.
- Larson, Ron; Falvo, David C. (30. 3. 2009). Elementary Linear Algebra, Enhanced Edition. Cengage Learning. стр. 8—. ISBN 978-1-305-17240-1.
- Hobson; Riley. Mathematical Methods For Physics And Engineering (Clpe) 2Ed. Cambridge University Press. ISBN 978-0-521-61296-8.
- Hemmer (2005). Kvantemekanikk: P.C. Hemmer. Tapir akademisk forlag. Tillegg 3: supplement to sections 3.1, 3.3, and 3.5. ISBN 978-82-519-2028-5.
- Quantum degeneracy in two dimensional systems, Debnarayan Jana, Dept. of Physics, University College of Science and Technology
- Al-Hashimi, Munir (2008). Accidental Symmetry in Quantum Physics.
- Orchin, M. Jaffe, H.H. (1967) The Importance of Antibonding Orbitals. Houghton Mifflin. ISBN B0006BPT5O
Спољашње везе
уреди- Java molecular orbital viewer shows orbitals of hydrogen molecular ion.
- The orbitron, a visualization of all atomic, and some molecular and hybrid orbitals
- xeo Visualizations of some atomic and molecular atoms