Хибридизација орбитала
Хибридизација је концепт мешања атомских орбитала при чему се формирају нове хибридне орбитале.[1] Хибридне орбитале су корисне за објашњење и описивање геометријског облика молекула.[2][3]
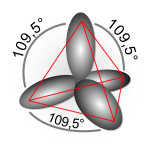
При мијешању s и p орбитала, долази до помијерања центра наелектрисања електронског облака у односу на s орбиталу.
Историјат
уредиТеорију хибридизације је први предложио хемичар Линус Паулинг како би објаснио структуру молекула као што је метан.[4] Према теорији и методи валентне везе, геометријски облик молекула и усмјереност веза у простору посљедица је преклапања атомских орбитала које је утолико повољније уколико може достићи максималну вриједност. Полазећи од електронске конфигурације некада је тешко објаснити усмјереност веза у простору. За описивање структуре таквих молекула користи се концепт хибридизације. Хибридизација није неопходна за описивање свих молекула, него углавном налази примјену за описивање геометријског облика молекула који садрже угљеник, азот, кисеоник и фосфор.
Врсте хибридизације
уредиХибридизација према броју модификованих атомских орбитала у угљениковом атому може бити:
- тетраедарска хибридизација - sp3 ( засићена органска једињења )
- тригонална - sp2 ( незасићена органска једињења са двогубом везом )
- дигонална - sp ( незасићена органска једињења са трогубом везом )
sp3 хибридизација
уредиПримјер sp3 хибридизације је молекул метана CH4, који има тетраедарски облик.
Атом угљеника у основном стању има конфигурацију:
Од четири валентна електрона угљеника два се налазе под правим углом(у двије p орбитале) а друга два се налазе у 2s орбитали те немају никакво усмјерење у простору, док су у молекулу метана валенце метана усмјерене тетраедарски у простору.
Угљеников атом при сједињавању најприје прелази у стање промоције (тј. један 2s електрон прелази у празну 2pz орбиталу):
Након тога долази до хибридизације, тј. до укрштања или мијешања једне 2s и три 2p орбитале (2px 2py 2pz). При томе настају четири једнаке орбитале усмјерене ка тјеменима тетраедра у простору. Ове орбитале се називају sp3 орбитале.
Прецизније речено sp3 хибридне орбитале се добију на основу рјешења Шредингерове једначине за конфигурацију електрона у побуђеном стању[5], тј. након промоције и представљају линерарну комбинацију s и p орбитала.[6]
Везивањем са четири атома водоника (преклапањем sp3 хибридних орбитала угљеника са 1s орбиталама водоника при чему се стварају четири сигма везе) настаје молекул метана који има тетраедарски облик. sp3 хибридизација је карактеристична за засићене угљоводонике.
До sp3 хибридизације долази и код атома кисеоника и азота у молекулу воде и амонијака. При томе у молекулу воде двије sp3 хибридне орбитале су преклопљене са 1s орбиталама два атома водоника(тј. успостављена је хемијска веза) а двије sp3 хибридне орбитале садрже два слободна електронска пара. Код молекула амонијака једна sp3 хибридна орбитала садржи слободан електронски пар. Слободни електронски парови се одбијају, а дјелују и на електроне у преосталим хибридним орбиталама због чега долази до смањивања угла између веза.
sp2 хибридизација
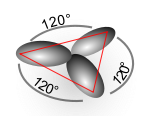
уредиПримјер sp2 хибридизације је молекул етена, који садржи двоструку везу између два атома угљеника. У молекулу етена су sp2 хибридизована оба атома угљеника. Код атома угљеника долази до мијешања 2s орбитале са двије 2p орбитале, при чему се добију три sp2 хибридне орбитале које се налазе у истој равни а угао између њих је 120° степени. Такође је остала и једна 2p орбитала која није хибридизована.
У молекулу етена два атома угљеника се међусобно спајају сигма ковалентном везом која настаје преклапањем двије sp2 орбитале и сваки атом угљеника ствара двије сигма везе са по два атома водоника преклапањем sp2 орбитале угљеника и 1s орбитале водоника. Такође се између два атома угљеника формира π веза бочним преклапањем двије 2p орбитале које су нормалне на раван молекула.
sp хибридизација
уредиДо sp хибридизације долази код алкина који садрже троструку везу између два атома угљеника. У овом случају 2s орбитала се мијеша само са једном 2p орбиталом при чему настају двије sp орбитале између којих је угао од 180° степени и остају двије 2p орбитале које су непромијењене.
У молекулу етина између два атома угљеника настаје једна сигма веза sp–sp преклапањем и двије додатне π везе које се добију бочним преклапањем p орбитала. Сваки атом угљеника ствара и једну сигма везу са атомом водоника s–sp преклапањем.
Хибридизација и облик молекула
уредиХибридизација може објаснити облике молекула:
- AX1 (нпр. LiH): не долази до хибридизације; тривијално линеаран
- AX2 (нпр. BeCl2): sp хибридизација линеаран или дијагоналан облик; угао између веза је 180°
- AX2E (нпр. GeF2): савијен V облик, < 120°
- AX3 (нпр. BCl3): sp2 хибридизација; тригонални планарни облик; углови између веза су 120°
- AX4 (нпр. CCl4): sp3 хибридизација; тетраедарски облик; углови између веза су ≈ 109.5°
- AX3E (нпр. NH3): тригонално пирамидални, угао између веза 107° (Слободни електронски пар незнатно мијења угао између веза због повећаног одбијања)
- AX5- (нпр. PCl5): sp3d хибридизација; тригонално бипирамидални облик
- AX6 (нпр. SF6): sp3d2 хибридизација; октаедарски (или квадратно бипирамидални облик).
Ако на централном атому има слободних електронских парова онда углови између веза постају мањи због повећаног одбијања. На примјер у молекулу воде H2O на атому кисеоника постоје двује везе са атомима водоника и два слободна електронска пара. Модел молекула је онда AX2E2 и долази до sp3 хибридизације и распоред електронских парова у молекулу воде је тетраедарски. Угао између веза је 104.5°.
Извори
уреди- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ Pauling, Linus (1988). General chemistry. Mineola, NY: Dover Publications, Inc. ISBN 978-0-486-65622-9.
- ^ Pauling, Linus (1954). „Modern structural chemistry, Nobel Lecture” (pdf).[мртва веза]
- ^ Pauling, L. (1931). „The Nature of the Chemical Bond. Application of Results Obtained from the Quantum Mechanics and from a Theory of Paramagnetic Susceptibility to the Structure of Molecules”. J. Am. Chem. Soc. 53: 1367—1400.
- ^ Wilson, E. J. N.; Pauling, Linus (1985). Introduction to quantum mechanics: with applications to chemistry. New York: Dover Publications. ISBN 978-0-486-64871-2.
- ^ McMurry John E. (1992). Fundamentals of Organic Chemistry (3rd изд.). Belmont: Wadsworth. ISBN 0-534-16218-5.
Литература
уреди- Pauling, Linus (1988). General chemistry. Mineola, NY: Dover Publications, Inc.
- Wilson, E. J. N.; Pauling, Linus (1985). Introduction to quantum mechanics: with applications to chemistry. New York: Dover Publications.
Спољашње везе
уреди- Covalent Bonds and Molecular Structure Архивирано на сајту Wayback Machine (10. фебруар 2009) ((језик: енглески))
- Hybridisation flash movie ((језик: енглески))