Boran
U hemiji, boran je hemijsko jedinjenje bora i vodonika. Borani obuhvataju veliku grupu jedinjenja sa opštom formulom BxHy.[3][4] Ta jedinjenja se ne javljaju u prirodi. Mnogi borani se lako oksiduju u kontaktu sa vazduhom, neki burno. Osnovni član BH3 se zove boran. On je poznat samo u gasovitom stanju. On se dimerizuje da formira diboran, B2H6. Veći borani se sastoje od klastera bora koji su poliedarski, neki od njih postoje kao izomeri. Na primer, izomeri B20H26 su bazirani na fuziji dva desetoatomna klustera.
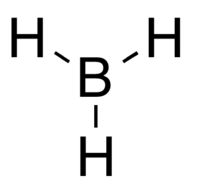
| |||
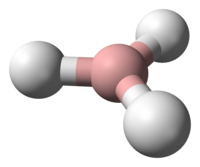 Model borana, BH3, koji je visoko reaktivan.
| |||
| |||
 BH3 formira dimeri diboran, B2H6.
| |||
| Identifikacija | |||
|---|---|---|---|
3D model (Jmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| |||
| Svojstva | |||
| BH3 | |||
| Molarna masa | 13,835 | ||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |||
| Reference infokutije | |||
Najvažniji borani su diboran B2H6, pentaboran B5H9, i dekaboran B10H14. Razvoj hemije bor hidrida je omogućio razvoj novih eksperimentalnih tehnika i teoretskih koncepta. Bor hidridi su studirani kao potencijalna goriva za raketa i za automobilsku primenu.
Tokom zadnjih nekoliko dekada, doseg hemije bor hidrida je porastao da obuhvati atome osom bora, kao što je ugljenik u karboranima i metali u metalboranima, gde je jedan ili više atoma bora zamenjen metalnim atomima.
Osobine
уредиBorani koje je koristio i pravio Alfred Štok imali su opstu formulu BnHn+4 i BnHn+6, ali danas su poznata i kompleksnija jedinjenja, kako neutralna tako i negativna (anjonska). Hidridi bora brojniji su od hidrida svih ostalih elemenata sem ugljenika. Najjednostavniji boran koji se može izolovati je B2H6, diboran(6). On se najviše koristi i istražuje. Komercijalno je dostupan, i dug niz godina borani i njihovi derivati sintetisani su upravo od njega, direktno ili indirektno. Slobodni molekuli BH3 (i B3H7) su veoma nestabilni, ali mogu biti izolovani kao stabilni produkti adicije sa Luisovim bazama, na primer BH3·N(CH3)3. Borani mogu biti u sva tri agregatna stanja, i njihove tačke topljenja i ključanja rastu sa relativnom atomskom masom i kompleksnošću.
| tačka topljenja (°C) | tačka ključanja (°C) | |
|---|---|---|
| B2H6, diboran(6) | -165 | -93 |
| B4H10, tetraboran(10) | -122 | 16 |
| B5H9, pentaboran(9) | -47 | 60 |
| B5H11, pentaboran(11) | -123 | 65 |
| B6H10, heksaboran(10) | -62 | 108 |
| B10H14, dekaboran(14) | 100 | 213 |
| Osobina | Vrednost |
|---|---|
| Particioni koeficijent[5] (ALogP) | 3,2 |
| Rastvorljivost[6] (logS, log(mol/L)) | 1,4 |
| Polarna površina[7] (PSA, Å2) | 0,0 |
Istorija
уредиHidrate borana je prvi put sistematično sintetisao i okarakterisao između 1912. i 1937. godine Alfred Štok. Hidridi ugljenika (nalazi se do bora u PSE) su alkani (zasićeni ugljovodonici), pa je Štok analogno nazvao hidride bora boranima. Posto lakši borani burno reaguju, toksični su i osetljivi na vazduh i vlažnost, Štok je razvio metode i aparaturu za proučavanje borana koja je koristila vakuum. Americki rad na boranima počeli su 1931. godine Herman I. Slesinger i Anton B. Burg. Borani su bili samo u akademskim interesima sve do Drugog svetskog rata, kada je američka vlada podržala istraživanje da se nadju eksplozivna jedinjenja uranijuma zbog izdvajanja izotopa, i 1950-ih godina kada je američka vlada podržala programe da se pronadju visoko-energetska goriva za rakete i mlaznjake (borani i njihovi derivati imaju mnogo veće toplote sagorevanja od ugljovodonika). Vilijam Lipskomb Junior je 1976. godine dobio Nobelovu nagradu iz hemije za "njegova istraživanja strukture borana, osvetljujuci probleme hemijskih veza". Herbert Braun, njegov učenik, je 1979. godine delio Nobelovu nagradu za reakciju hidroborovanja (1956), veoma jednostavnu reakciju adicije BH3 nezasićenim organskim jedinjenjima (npr. alkeni i alkini) u etarskim rastvaracima na sobnoj temperaturi da bi nastali organoborani kvantitativno (visok prinos, skoro potpuna reakcija). Reakcija hidroboracije je otvorila nove perspektive u oblasti nekih organskih sinteza.[8].
Reference
уреди- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th изд.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
- ^ Ghose, A.K.; Viswanadhan V.N. & Wendoloski, J.J. (1998). „Prediction of Hydrophobic (Lipophilic) Properties of Small Organic Molecules Using Fragment Methods: An Analysis of AlogP and CLogP Methods”. J. Phys. Chem. A. 102: 3762—3772. doi:10.1021/jp980230o.
- ^ Tetko IV, Tanchuk VY, Kasheva TN, Villa AE (2001). „Estimation of Aqueous Solubility of Chemical Compounds Using E-State Indices”. Chem Inf. Comput. Sci. 41: 1488—1493. PMID 11749573. doi:10.1021/ci000392t.
- ^ Ertl P.; Rohde B.; Selzer P. (2000). „Fast calculation of molecular polar surface area as a sum of fragment based contributions and its application to the prediction of drug transport properties”. J. Med. Chem. 43: 3714—3717. PMID 11020286. doi:10.1021/jm000942e.
- ^ Enciklopedija Britanika, http://www.britannica.com/EBchecked/topic/73805/borane
Literatura
уреди- Fox, Mark A.; Wade, Ken (2003). „Evolving patterns in boron cluster chemistry”. Pure Appl. Chem. 75 (9): 1315—1323. doi:10.1351/pac200375091315.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (II изд.). Oxford: Butterworth-Heinemann. ISBN 0080379419.
- Cotton F. Albert; Wilkinson Geoffrey; Murillo Carlos A; Bochmann, Manfred (1999). Advanced Inorganic Chemistry (6th изд.). New York: Wiley-Interscience. ISBN 0-471-19957-5.

