Кватернарни амонијум катјон
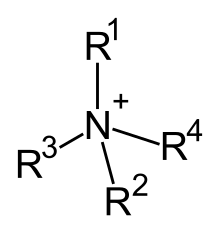
Кватернарни амонијум катјони су позитивно наелектрисани полиатомски јони са структуром НР+
4, при чему је R алкил или арил група.[1] За разлику од амонијум јона (НХ+
4) и примарних, секундарних, или терцијарних амонијум катјона, кватернарни амонијум катјони су перманентно наелектрисани, независно од pH њиховог раствора. Кватернарне амонијум соли или кватернарна амонијум једињења (звана кватернарни амини у жаргону нафтних поља) су соли кватернарних амонијум катјона.
Синтеза
уредиКватернарни амонијум катјони се припремају алкилацијом терцијарних амина са халоугљеником.[2] У старијој литератури то се обично назива Меншуткиновом реакцијом, док се у модерним изворима једноставно назива кватернизацијом.[3] Ова реакција се може користити за формирање једињења са неједнаким дужинама алкилних ланаца; на пример при прављењу катјонских сурфактаната једна од алкил група амина је обично дужа од других.[4] Типична синтеза бензалконијум хлорида се изводи користећи дуголанчани алкилдиметиламин и бензил хлорид:
- CH3(CH2)nN(CH3)2 + ClCH2C6H5 → [CH3(CH2)nN(CH3)2CH2C6H5]+Cl−
Реакције
уредиКватернарни амонијум катјони нису реактивни према јаким електрофилима, оксидансима, и киселинама. Они су исто тако стабилни према већини нуклеофила. Ово задње својство се на пример испољава у виду стабилности хидроксидних соли као што су тетраметиламонијум хидроксид и тетрабутиламонијум хидроксид. Због њихове отпорности, многи необични ањони су били изоловани као квартернарне амонијум соли. Примери обухватају тетраметиламонијум пентафлуороксенат, који садржи високо реактивни пентафлуороксенатни (XеФ−
5) јон. Перманганат се може растворити у органским растварачима, кад се користи његова NBu+
4 со.[5][6]
Са изузетно јаким базама, кватернарни катјони се деградирају. Они подлежу Сомалет-Хаусером[7] и Стивенсовом реаранжману,[8] као и деалкилацији под оштрим условима. Кватернарни амонијум катјони који садрже N–C–C–H јединице могу да подлегну Хофмановој елиминацији и Емдеовој деградацији.
Види још
уреди- Бензалконијум хлорид, бензетонијум хлорид, метилбензетонијум хлорид, кеталконијум хлорид, цетилпиридинијум хлорид, цетримонијум, цетримид, дофанијум хлорид, тетраетиламонијум бромид, и домифен бромид – антимикробни су ингредијенти присутни у разним продуктима на слободно
- Дикват - дикватернарно амонијум једињење које се користи као контактни хербицид
- Карнитин
- Цетримонијум бромид (CTAB), стеаралконијум хлорид – катјонски сурфактанти са широким опсегом козметичких примена
- Холин
- Кокамидопропил бетаин (CAPB), чест цвитерјонски сурфактант у козметичким применама
- Денатонијум, најгорчије познато једињење
- Диметилдиоктадециламонијум хлорид
- Паракват, хербицид
- Поликватернијум, полимери који садрже квартерне амонијеве соли, који се користе за производе за личну негу
- Кватернарно амонијумски мишићни релаксанти
- Силицијумски кватернарни амин
- Тетра-n-бутиламонијум бромид и Аликват 336, чести катализатори фазног трансфера
- Тетраметиламонијум хлорид
- Тетраметиламонијум хидроксид
- Тетраметиламонијум пентафлуороксенат, садржи необични пентагонални пентафлуороксенатни (XeF5−) јон
- Триазен
Референце
уреди- ^ ИУПАЦ. „qуатернарy аммониум цомпоундс”. Компендијум хемијске терминологије (Интернет издање).
- ^ Брасен, C. Р.; Хаусер (1954). „о-Метхyлетхyлбензyл Алцохол”. Орг. Сyнтх. 34: 58. дои:10.15227/оргсyн.034.0058.
- ^ Смитх, Мицхаел Б.; Марцх, Јеррy (2001). Адванцед Органиц Цхемистрy: Реацтионс, Мецханисмс, анд Струцтуре (5тх изд.). Неw Yорк, НY: Wилеy-Интерсциенце. ИСБН 978-0-471-58589-3.
- ^ „Сурфацтантс”. Уллманн’с Енцyцлопедиа оф Индустриал Цхемистрy. Wеинхеим: Wилеy-ВЦХ. 2005. дои:10.1002/14356007.а25_747.
- ^ Херриотт, Артхур W. (1977). „Пурпле бензене: Солубилизатион оф анионс ин органиц солвентс”. Ј. Цхем. Едуц. 54 (4): 229. Бибцоде:1977ЈЦхЕд..54Q.229Х. дои:10.1021/ед054п229.1.
- ^ Дохенy, Антхонy Ј., Јр.; Ганем, Бруце (1980). „Пурпле бензене ревиситед”. Ј. Цхем. Едуц. 57 (4): 308. Бибцоде:1980ЈЦхЕд..57..308Д. дои:10.1021/ед057п308.1.
- ^ Брасен, W. Р.; Хаусер, C. Р. (1963). „2-Метхyлбензyлдиметхyламине”. Орг. Сyнтх.; Цолл. Вол., 4, стр. 585
- ^ Пине, Станлеy Х. (2011). „Тхе Басе-Промотед Реаррангементс оф Qуатернарy Аммониум Салтс”. Органиц Реацтионс. ИСБН 978-0-471-26418-7. дои:10.1002/0471264180.ор018.04.
Литература
уреди- Пине, Станлеy Х. (2011). „Тхе Басе-Промотед Реаррангементс оф Qуатернарy Аммониум Салтс”. Органиц Реацтионс. ИСБН 978-0-471-26418-7. дои:10.1002/0471264180.ор018.04.
- Смитх, Мицхаел Б.; Марцх, Јеррy (2001). Адванцед Органиц Цхемистрy: Реацтионс, Мецханисмс, анд Струцтуре (5тх изд.). Неw Yорк, НY: Wилеy-Интерсциенце. ИСБН 978-0-471-58589-3.
Спољашње везе
уреди- Тоxицитиес оф qуатернарy аммониум
- Зханг, Цханг; Цуи, Фанг; Зенг, Гуанг-минг; Јианг, Мин; Yанг, Зхонг-зху; Yу, Зхи-ганг; Зху, Менг-yинг; Схен, Лиу-qинг (15. 6. 2015). „Qуатернарy аммониум цомпоундс (QАЦс): А ревиеw он оццурренце, фате анд тоxицитy ин тхе енвиронмент”. Сци. Тотал Енв. 518–519: 352—362. дои:10.1016/ј.сцитотенв.2015.03.007.