Камфор
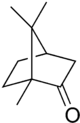
Камфор је смоласта материја, бела или безбојна, горког укуса, расхлађујућег и специфично јаког мириса. Представља главни састојак етарског уља камфоровог дрвета (Cinnamomum camphora), високог зимзеленог дрвета које расте у Азији (посебно на Борнеу и Тајвану), а може се наћи и у дрвету -Dryobalanops aromatica}-, џиновском стаблу у шумама Борнеа. По свом хемијском саставу, то је терпеноид са формулом C10H16O. Јавља се и у неким другим биљкама из фамилије -Lauraceae}-, посебно у јединкама врсте -Ocotea usambarensis}-. Може бити и вјештачки справљено од терпентинског уља. Због свог мириса се користи као зачин (најчешће у индијској кухињи), али и у вјерским обредима и у медицинске сврхе. Раствара се у масним уљима, етарским уљима и етанолу.
| |
| |
| Називи | |
|---|---|
| IUPAC називs
1,7,7-trimethylbicyclo
[2.2.1]heptan-2-one | |
| Други називи
2-bornanone, 2-camphanone
bornan-2-one, Formosa | |
| Идентификација | |
3Д модел (Jmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.000.860 |
| RTECS | EX1260000 (R) EX1250000 (S) |
| |
| |
| Својства | |
| C10H16O | |
| Моларна маса | 152,23 |
| Агрегатно стање | Бели или безбојни кристали |
| Густина | 0,990 (чврсто стање) |
| Тачка топљења | 179.75 °C (452.9 K) |
| Тачка кључања | 204 °C (477 K) |
| 0.12 g у 100 ml | |
| Растворљивост у хлороформ | ~100 g у 100 ml |
| Хирална ротација [α]D | +44.1° |
| Опасности | |
| Главне опасности | запаљив |
| R-ознаке | 11-20/21/22-36/37/38 |
| S-ознаке | 16-26-36 |
| NFPA 704 | |
| Сродна једињења | |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25°C [77°F], 100 kPa). | |
| Референце инфокутије | |
Норкамфор је дериват камфора, у којем су три његове метилне групе замијењене водоником.
Издвајање
уредиНајвећи садржај камфора се налази у етарском уљу које се добија дестилацијом коре коријена камфоровог дрвета. То етарско уље садржи око 30-50% камфора. Након дестилације, етарско уље се хлади, при чему се камфор издваја као талог који се од течности одваја центрифугирањем, а преостала количина камфора, која је остала у течном дијелу (не издваја се сав камфор хлађењем), издваја се такозваном фракционом дестилацијом.
Употреба
уредиКамфор се употребљава у облику раствора и линимената (мазила) за утрљавање код реуматских болова, миалгија, неуралгија. Главна дјеловања камфора су иритантно и антисептично. Раније се користио као стимуланс дисања у облику инјекција или инхалација.
Камфор може изазвати јаку иритацију праћену боловима код дјеце, старијих особа или преосетљивих особа свих животних доба.
Реакције
уредиТипичне реакције камфора су:
- конверзија у изонитрозокамфор.
Камфор се може редуковати у изоборнеол користећи натријум борохидрид.
Извори
уреди- ^ Susan Budavari, ур. (2001). The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (13th изд.). Merck Publishing. ISBN 0911910131.
- ^ Lide David R., ур. (2006). CRC Handbook of Chemistry and Physics (87th изд.). Boca Raton, FL: CRC Press. ISBN 978-0-8493-0487-3.
- ^ „CAS No.464-49-3,(1R,4R)-(+)-Camphor Suppliers,MSDS download”.
- ^ „CAS No.464-48-2,l-Camphor Suppliers”.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
