Калијум хлорат
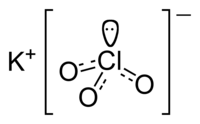
Калијум хлорат је хемијско једињење које се састоји од калијума, хлора и кисеоника. Његова молекулска формула је KClO3. Спада у калијумове соли хлорне киселине.[1][2]
| |

| |
| Називи | |
|---|---|
| Други називи
Калијум хлорат(V)
| |
| Идентификација | |
| ECHA InfoCard | 100.021.173 |
| MeSH | Potassium+chlorate |
| Својства | |
| KClO3 | |
| Моларна маса | 122,55 g/mol |
| Агрегатно стање | Бели кристали или прах |
| Густина | 2,32 g/cm³, основно |
| Тачка топљења | 356 °C |
| Тачка кључања | ~400 °C, разлаже се |
| 7.3 g/100 ml (20 °C) (70F) | |
| Структура | |
| Кристална решетка/структура | ? |
| Опасности | |
ЕУ класификација (DSD)
|
Оксидант (O) Шкодљив (Xn) Опасан за животну средину (N) |
| R-ознаке | R9, R22, R51/53 |
| S-ознаке | (S2), S13, S17, S46, S61 |
| NFPA 704 | |
| Тачка паљења | none |
| Сродна једињења | |
Други анјони
|
Калијум-бромат Калијум-јодат |
Други катјони
|
Амонијум-хлорат Натријум-хлорат |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25°C [77°F], 100 kPa). | |
| Референце инфокутије | |
У свом чистом облику, то је бела кристална супстанца. После натријум хлората, то је други најчешћи хлорат у индустријској употреби. То је јако оксидационо средство и његова најважнија примена је у сигурносним шибицама.[3] У другим применама је углавном застарео и замењен је сигурнијим алтернативама последњих деценија. Коришћено је као:
- Оксидационо средство,
- У ватрометима, ракетним горивима и експлозивима,
- За припрему кисеоника, како у лабораторији тако иу хемијским генераторима кисеоника,
- Као дезинфекционо средство, на пример у у медицинским испирањима уста,
- У пољопривреди као хербицид.
Производња
уредиНа индустријској скали, калијум-хлорат се производи реакцијом метатезе соли натријум-хлората и калијум-хлорида:
Реакцију покреће ниска растворљивост калијум хлората у води. Равнотежа реакције се помера на десну страну континуираним таложењем производа (Ле Шателијеов принцип). Претеча натријум хлората се индустријски производи у веома великим количинама електролизом натријум хлорида, обичне кухињске соли.[3]
Понекад се користи и директна електролиза KCl у воденом раствору, при чему ниска растворљивост KClO3 у води узрокује да се со лако изолује из реакционе смеше једноставним таложењем из раствора.
Калијум хлорат се може произвести у малим количинама диспропорцијацијом у раствору натријум хлорида праћено реакцијом метатезе са калијум хлоридом:
Može se proizvesti i prolaskom hlornog gasa kroz vrelu otopinu kaustične kiseline:[4]
Синтеза калијум хлората се може извршити електролизом раствора натријум хлорида и таложењем произведеног натријум хлората са калијум хлоридом. Да би се извршила ова конкретна електролиза, уместо раздвајања катоде (од челика) и аноде (од активног титанијума) помоћу мембране као што се ради у хлор-алкалном процесу, они морају бити супротстављени: тако да се хлор који се дисоцира електролизом реагује са каустичном содом и формира натријум хипохлорит:
При високим температурама, натријум хипохлорит се дисоцира у хлориде и хлорате:
Али можемо добити калијум-хлорат директно, електролизом раствора калијум-хлорида; механизам реакције је следећи:
На катоди:
На аноди:
У прошлости, калијум хлорат се производио мешањем хлора у раствору каустичне соде. Прво су формирани калијум хлорид и калијум хипохлорит у једнаким размерама. Топлота произведена егзотермном природом ове реакције била је довољна да се хипохлорит раздвоји на два дела хлорида и један део калијум-хлората. Дакле, налазимо у основи исте реакције као и раније, али са скупљим реагенсима (хлорни гас и каустична сода), али без коришћења електричне енергије. Хемијска једначина изгледа овако:
Међутим, видимо да је хлорат фиксирао само шестину инвестираног хлора.
Употреба
уредиКалијум хлорат је био један од кључних састојака у раним ударним капислама (прајмерима) за ватрено оружје. Наставља се са том применом, где га није заменио калијум перхлорат.
Погонска средства на бази хлората су ефикаснија од традиционалног барута и мање су подложна оштећењима од воде. Међутим, они могу бити изузетно нестабилни у присуству сумпора или фосфора и много су скупљи. Хлоратна горива се морају користити само у опреми која је за њих пројектована; непоштовање ове мере предострожности је чест извор несрећа. Калијум хлорат, често у комбинацији са сребрним фулминатом, користи се у триковима који стварају буку познатим као "крекери", "снаппери", "поп-итс", "цапс" или "банг-снапс", популарна врста новогодишње пиротехнике.
Друга примена калијум хлората је као оксидатор у димној композицији попут оне која се користи у димним гранатама (бомбама). Од 2005. патрона са калијум хлоратом помешаним са лактозом и колофонијумом (смолом) се користи за стварање белог дима који сигнализира избор новог папе на папској конклави.[5]
Лабораторије средњих школа и факултети често користе калијум хлорат за стварање гаса кисеоника. То је далеко јефтинији извор од резервоара кисеоника под притиском или криогеног резервоара. Калијум хлорат се лако распада ако се загрева док је у контакту са катализатором, обично манган(IV) диоксидом (MnO2). Дакле, може се једноставно ставити у епрувету и загрејати изнад горионика. Ако је епрувета опремљена чепом и цревом са једном рупом, топли кисеоник се може извући. Реакција је следећа:
Загревањем у одсуству катализатора се претвара у калијум перхлорат: [8]
Даљим загревањем, калијум перхлорат се разлаже на калијум хлорид и кисеоник:
Безбедно извођење ове реакције захтева веома чисте реагенсе и пажљиву контролу температуре. Растопљени калијум хлорат је изузетно моћан оксидант и спонтано реагује са многим уобичајеним материјалима као што је шећер. Експлозије су настале услед прскања течних хлората у латекс или ПВЦ цеви генератора кисеоника и од контакта између хлората и угљоводоничних заптивних масти. Нечистоће у самом калијум хлорату такође могу проузроковати проблеме. Када радите са новом серијом калијум хлората, препоручљиво је узети мали узорак (~1 грам) и снажно га загрејати на отвореној стакленој плочи. Контаминација може изазвати експлозију ове мале количине, што указује на то да хлорат треба одбацити.
Калијум-хлорат се користи у хемијским генераторима кисеоника (који се такође називају хлоратне свеће или кисеоникове свеће), који се користе као системи за снабдевање кисеоником нпр. авиона, свемирских станица, подморница, и одговоран је за најмање једну авионску несрећу. Пожар на свемирској станици Мир је био повезан са свећама за производњу кисеоника које користе сличан литијум перхлорат. Разлагање калијум хлората је такође коришћено да се обезбеди снабдевање кисеоником за рефлекторе.
Калијум хлорат се такође користи као пестицид. У Финској се продавао под трговачким именом Фегабит.
Калијум хлорат може реаговати са сумпорном киселином и формирати високо реактиван раствор хлорне киселине и калијум сулфата:
Тако произведен раствор је довољно реактиван да се спонтано запали ако је присутан запаљиви материјал (шећер, папир, итд.).
У хемијским лабораторијама користи се за оксидацију HCl и ослобађање малих количина гасовитог хлора.
Устаници у Авганистану такође увелико користе калијум хлорат као кључни састојак у производњи импровизованих експлозивних направа. Када су уложени значајни напори да се смањи доступност амонијум-нитратног ђубрива у Авганистану, произвођачи IED-а почели су да користе калијум-хлорат као јефтину и ефикасну алтернативу. У 2013. години, 60% IED у Авганистану користило је калијум хлорат, што га чини најчешћим састојком који се користи у у IED-има.[6] Калијум-хлорат је такође био главни састојак ауто-бомбе коришћене у бомбашким нападима на Балију 2002. у којима су погинуле 202 особе.
Калијум хлорат се користи за форсирање фазе цветања лонган дрвета, узрокујући да производи плодове воћа у топлијим климама.[7]
Калијум-хлорат се углавном користи у пиротехници, на пример за припрему молотовљевог коктела,[8] као и за хлоратне експлозиве, који се данас више не користе (мешавина KClO3 и органског горива – нпр. уље, дрвено брашно, божићних петарди...) . У прошлости се користио за бојење коже.
Такође се користи у ватрометима и петардама, али посебно за прављење шибица. За ватромет се замењује што је више могуће калијум перхлоратом, који је мање опасан за руковање. Међутим, понекад се тражи калијум хлорат да би се добиле спектакуларне боје у пиротехничким догађајима.[9]
Такође се природно користио за производњу експлозива. Хлоратит садржи нпр. приближно 90% калијум хлората, 10% угљоводоника и додатак на бази пиљевине; али овај експлозив осетљив на трење је у великој мери замењен оксидантима који су мање опасни за руковање и који су најмање ефикасни као калијум перхлорат, посебно за припрему знатно стабилнијих експлозива. Ако се тражи мање опасан оксидант, нпр. за прајмер црног барута за ватромете, или пиротехничке бомбе, данас се уместо тога ослањамо на традиционални калијум нитрат.
Употреба алжирских бомби, ових петарди направљених од мешавине калијум хлората, црвеног фосфора и сушеног гумиарабика, обликованих у лопту и умотаних у папир, није без опасности. Ова мешавина калијум хлората се обично назива Армстронгова смеша и њено директно руковање скоро увек доводи до повреда, због њене осетљивости на најмањи удар, трење или електростатичко пражњење.
Ова високоексплозивна супстанца се такође користи за паљење сигурносних шибица: она чини упаљач шибице и реагује са траговима црвеног фосфора са шибица. Раздвајање материјала два реагенса тада је представљало праву производну тајну, коју је 1844. открио шведски хемичар Густаф Ерик Паш: тако да се шибица не може спонтано запалити; јер су фосфорне шибице и сумпорни штапићи заменили јер су садржавали калијум хлорат.[10]
Калијум-хлорат, као и натријум-хлорат, некада се користио као хербицид све до забране.[11]
Уопштено говорећи, чистим калијум хлоратом треба руковати само са великом пажњом, јер и најмања нечистоћа, не само фосфора, већ чак и сумпорна или метална струготина, вероватно ће га учинити експлозивним.
Калијум хлорат је улазио у састав различитих врста јаке воде, "холандске киселине (или нагризивача)", препарат плоча за гравирање састављен од 88% воде, 10% димеће хлороводоничне киселине и 2% хлората.[12]
Nekada se verovalo da kalijum-hlorat ima antiseptičko dejstvo, који се користио у саставу течности за испирање уста,[13] али је ова теза сада контроверзна, чак доведена у питање. Максимална терапеутска доза, односно нетоксична доза, износи 1 g за одраслу особу:[10] преко тога, оштећује крв и уништава нервно ткиво. Смртоносна доза је 5 до 15 g.[14] Данас се сумња у његово антисептичко дејство: с обзиром на његову токсичност, боље је избегавати његову употребу у фармакопеји.
Међутим, назив Калијум хлоратум, која се налази између осталог у одређеним хомеопатским препаратима, у облику креме или гранула, представља латинску форму калијум хлорида, и нема никакве везе са токсичним хлоратом.
Безбедност
уредиКалијум хлоратом треба пажљиво руковати. Реагује снажно, и у неким случајевима се спонтано запали или експлодира, када се помеша са многим запаљивим материјалима. Снажно гори у комбинацији са готово свим запаљивим материјалима, чак и оним који су обично слабо запаљиви (укључујући обичну прашину и влакна). Смеше калијум хлората и горива могу да се запале у контакту са сумпорном киселином, па их треба држати подаље од овог реагенса. Сумпор треба избегавати у пиротехничким композицијама које садрже калијум хлорат, јер су ове смеше склоне спонтаној дефлаграцији. Већина сумпора садржи трагове киселина које садрже сумпор, а оне могу изазвати спонтано паљење - "Цветови сумпора" или "сублимирани сумпор", упркос укупној високој чистоћи, садрже значајне количине сумпорних киселина. Такође, мешавине калијум хлората са било којим једињењем са својствима подстицања паљења (нпр. Антимон(III) сулфид) су веома опасне за припрему, јер су изузетно осетљиве на удар.
Ризик
уредиКалијум хлорат је токсична и штетна супстанца по здравље која загађује животну средину. Може ослободити високо штетна једињења хлора. Због својих оксидационих својстава гори чак и под водом. Калијум-хлорат спада у материје (тзв. експлозивни прекурсори) за које је предложено да буду забрањене за продају широј јавности.[15]
Види још
уредиРеференце
уреди- ^ Handbook of Inorganic Chemicals. McGraw-Hill. 2002. ISBN 978-0-07-049439-8.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. изд.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ а б Vogt, Helmut; Balej, Jan; Bennett, John E.; Wintzer, Peter; Sheikh, Saeed Akbar; Gallone, Patrizio (15. 6. 2000). „Chlorine Oxides and Chlorine Oxygen Acids”. Ур.: Ullmann. Ullmann's Encyclopedia of Industrial Chemistry. Wiley‐VCH Verlag. ISBN 9783527303854. doi:10.1002/14356007.a06_483.
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ Daniel J. Wakin and Alan Cowell (13. 3. 2013). „New Round of Voting Fails to Name a Pope”. The New York Times. Приступљено 13. 3. 2013.
- ^ „Afghan bomb makers shifting to new explosives for IEDs”. USAToday.com. 25. 6. 2013. Приступљено 2013-06-25.
- ^ Manochai, P.; Sruamsiri, P.; Wiriya-alongkorn, W.; Naphrom, D.; Hegele, M.; Bangerth, F. (12. 2. 2005). „Year around off-season flower induction in longan (Dimocarpus longan, Lour.) trees by KClO3 applications: potentials and problems”. Scientia Horticulturae. Department of Horticulture, Maejo University, Chiang Mai, Thailand; Department of Horticulture, Chiang Mai University, Chiang Mai, Thailand; Institute of Special Crops and Crop Physiology, University of Hohenheim, 70593 Stuttgart, Germany. 104 (4): 379—390. doi:10.1016/j.scienta.2005.01.004. Приступљено 28. 11. 2010.
- ^ prskavek,Sovětské zápalné láhve Архивирано на сајту Wayback Machine (7. децембар 2013)
- ^ Takeo Shimizu. Fireworks — The Art, Science and Technique (4e изд.). Midland (Texas): Pyrotechnica Publications. стр. 53 et suiv., p. 92 et suiv. ISBN 0-929388-05-4.
- ^ а б Alexander P. Hardt (2001). Pyrotechnics. Post Falls, Idaho, USA: Pyrotechnica Publications. стр. 74 i dalje. ISBN 0-929388-06-2.
- ^ Règlement n° 98/2013 de l’Union européenne ; article 115 de la loi n° 2016-731 du 3 juin 2016 (codifié à l’art. L. 2351-1 du code de la défense).
- ^ Manly Banister (1969). „3. Etching the plate”. Practical Guide to Etching and Other Intaglio Printmaking Techniques (на језику: енглески). New York: Sterling Publ. Co. стр. 28.
- ^ Céline Couteau (13. 03. 2018). „Si Grand-mère sait faire un bon café, Boiron, en revanche, n’est pas fort en produits bucco-dentaires…”. Regard sur les cosmétiques. Приступљено 6. 11. 2021.
- ^ Hermann Ammon (2014). „Kaliumchlorat”. Hunnius pharmazeutisches Wörterbuch (на језику: немачки) (11 изд.). Berlin: de Gruyter. ISBN 978-3-11-030990-4.
- ^ Návrh Nařízení Evropského parlamentu a Rady na regulaci prodeje a používání prekurzorů výbušnin
Литература
уреди- Handbook of Inorganic Chemicals. McGraw-Hill. 2002. ISBN 978-0-07-049439-8.
- Patnaik, Pradyot (2002). Handbook of Inorganic Chemicals. McGraw-Hill. ISBN 978-0-07-049439-8.
- Vohlídal, Jiří; Štulík, Karel; Julák, Alois (1999). Chemické a analytické tabulky (1 изд.). Prag: Grada Publishing. ISBN 80-7169-855-5.
