Калијум сулфид
Калијум сулфид је неорганско једињење са формулом К2S.[3][4] Ова безбојна чврста материја се ретко среће, јер брзо реагује са водом, при чему се формирају калијум хидросулфид (KSH) и калијум хидроксид (KOH). Најчешће се термин калијум сулфид користи у ширем смислу за ову мешавину, а не за анхиратни прах.
| |
| Називи | |
|---|---|
| IUPAC назив
Kalijum sulfid
| |
| Други називи
Дикалијум моносулфид,
Дикалијум сулфид, Калијум моносулфид, Калијум сулфид | |
| Идентификација | |
3Д модел (Jmol)
|
|
| ECHA InfoCard | 100.013.816 |
| RTECS | ТТ6000000 |
| |
| Својства | |
| K2S | |
| Моларна маса | 110,262 g/mol |
| Агрегатно стање | чист: безбојан са нечистоћама: жуто-браон |
| Мирис | HS |
| Густина | 1,74 g/cm3 |
| Тачка топљења | 840 °C |
| Тачка кључања | 912 °C (razlaže se) |
| ковертује се у KSH, KOH | |
| Растворљивост у други растварачи | растворан у етанолу, глицеролу нерастворан у етру |
| Структура | |
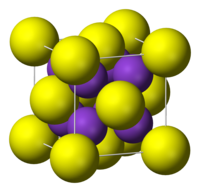
| Кристална решетка/структура | антиФлуорит |
| Опасности | |
| Опасност у току рада | Опасан за средину (N) |
| Р-ознаке | Р17, Р23, Р25, Р31, Р34, Р50 |
| С-ознаке | С24, С26 |
| Сродна једињења | |
Други катјони
|
Натријум сулфид, Гвожђе (II) сулфид |
Сродна једињења
|
Калијум хидросулфид, Калијум сулфит, Калијум сулфат |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25 °C [77 °F], 100 kPa). | |
| Референце инфокутије | |
Структура
уредиОн поприма "антифлуоритну структуру", што значи да мали К+ јони заузимају тетраедрална (F−) места у флуориту, и велики S2− центри имају осам координатних места. Li2S, Na2S, и Rb2S имају сличну кристалну структуру.[5]
Референце
уреди- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. изд.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ Holleman A. F.; Wiberg E. (2001). Inorganic Chemistry (1st изд.). San Diego: Academic Press. ISBN 0-12-352651-5.
- ^ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.