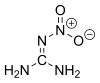
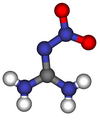
Нитрогванидин
Нитрогванидин - понекад скраћено НГу, такође назван пикрит - је безбојно експлозивно хемијско једињење, кристална чврста супстанца која није директно запаљива, која има веома ниску експлозивну осетљивост и топи се на 257 °Ц (495 °Ф; 530 К) и распада на 254 °Ц (489 °Ф; 527 К), али зато има велику брзину детонације.[3] Нитрогванидин је изузетно неосетљив, али моћан експлозив, такође се користи у бездимном баруту где смањује пламен на излазу из цеви и смањује ерозију цеви и буренцета.[4] Влажење са > 20 теж.% воде утиче на десензибилизацију са ХД 1.1 на ХД 4.1 (запаљива чврста супстанца).[5] Нитрогванидин се користи као енергетски материјал, односно погонско гориво или високо експлозивно средство, прекурсор за инсектициде и за друге сврхе.
| |||
| Називи | |||
|---|---|---|---|
| IUPAC назив
1-Nitroguanidine
| |||
| Други називи
Пикрит
| |||
| Идентификација | |||
3Д модел (Jmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.008.313 | ||
| |||
| Својства | |||
| CH4N4O2 | |||
| Моларна маса | 104,068 | ||
| Агрегатно стање | Безбојна кристална чврста супстанца | ||
| Густина | 1,77 g/cm3 | ||
| Тачка топљења | 257 °C (495 °F; 530 K) | ||
| 3.45 г/кг (у води при 25 °Ц (77 °Ф; 298 К)) | |||
| Експлозивност | |||
| Осетљивост на шок | > 50 Ј | ||
| Осетљивост на трење | > 350 Н | ||
| Брзина детонације | |||
| РЕ фактор | 1.00
| ||
| Опасности | |||
| Главне опасности | Експлозив | ||
| Безбедност приликом руковања | |||
|
| |||
| Сродна једињења | |||
Сродна
|
|||
Сродна једињења
|
Гванидин Гванидин нитрат
| ||
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25 °C [77 °F], 100 kPa). | |||
| Референце инфокутије | |||
Нитрогванидин је такође органско једињење, које садржи 1 атом угљеника и има молекулску масу од 104,068 Da.
Историја
уредиНитрогванидин је први изумео L. Јоусселин 1877. године. Око Другог светског рата почео је да се користи као барут.
Производња
уредиНитрогванидин је синтетисан по први пут 1877. године[3] нитрацијом гванидина[6], а затим је са великим потешкоћама добијен екстракцијом гвана.[7] Од 1930-их,[3] индустријски се производи дехидратацијом сумпорном киселином самог гванидин нитрата[8] добијеног реакцијом цијанамида или дицијандиамида[9] и амонијум нитрата.[3] · [10] · [11] Гванидин нитрат се такође може произвести из уреје и амонијум нитрата са силицијум-диоксидним катализатором[12]али у лабораторији се може припремити од урее О=C(НХ
2)
2 и сулфаминске киселине Х
3НСО
3 да би се добио гванидин сулфат који је накнадно нитрован у нитрогванидин.[13]
Нитрогванидин се производи широм света у великим размерама почевши од реакције дицијандиамида (ДЦД) са амонијум нитратом да би се добила со гванидинијум нитрата, која се затим нитрира третманом са концентрованом сумпорном киселином на ниској температури.[14]
- [C(НХ2)3]НО3 → (НХ2)2ЦННО2 + Х2О
Нитрогванидин се такође може добити третирањем урее амонијум нитратом (преко БМА процеса). Међутим, због проблема поузданости и сигурности, овај процес никада није комерцијализован упркос својим атрактивним економским карактеристикама.
Особине
уреди| Особина | Вредност |
|---|---|
| Број акцептора водоника | 3 |
| Број донора водоника | 3 |
| Број ротационих веза | 2 |
| Партициони коефицијент[15] (ALogP) | 1,2 |
| Растворљивост[16] (logS, log(mol/L)) | -0,3 |
| Поларна површина[17] (PSA, Å2) | 107,7 |
Карактеристике
уредиНитрогванидин је веома неосетљив и детонира тек након иницирања детонатором. Важни индикатори експлозије су:
- Топлота експлозије: 3062 кЈ кг−1.[18]
- Температура детонације: при максималној густини 2.530 °Ц (4.590 °Ф; 2.800 К)[19]
- Брзина детонације: при максималној густини 8.546 м/с (28.040 фт/с)−1[18]
- Нормална запремина гаса: 1075 л·кг−1.[20]
- Специфична енергија: 932 кЈ·кг−1.[20]
- Детонациони притисак: 29 ГПа
- Температура детонације: 2.540 °Ц (4.600 °Ф; 2.810 К)[19]
- Оловни блок: 305 цм3/10 г[20]
- Осетљивост на удар: до 50 Нм без реакције[21]
- Осетљивост на трење: до 353 Н оптерећење игле без реакције[21]
- Критични пречник при густини: при густини од 1,52 г/цм 3 < 14 мм[18]
- Испитивање челичног кућишта: са граничним пречником од 1 мм без паљења.[21]
Као и код свих експлозива, брзина детонације, вD, нитрогванидина расте са његовом густином. вD следи следећи закон у опсегу од 0,3 до 1,78 г·цм−3: вD = 1,44 + 4,015 густина [мм·µс−1][22] (погледајте и следећу графику)
Нитрогванидин је један од јаких, али тешко детонирајућих експлозива. Ово објашњава снажну зависност брзине детонације од пречника. Пуњење густине 0,95 г/цм3 има брзину детонације од 4.340 м/с (14.240 фт/с) у цеви унутрашњег пречника 20 мм.
Синтеза
уредиНитрогванидин се може добити дехидратацијом гванидин нитрата концентрованом сумпорном киселином.[23]
- Х
2Н-C(=НХ)-Х
2Н·ХНО
3 → Х
2Н-C(-НХ
2)=Н-НО
2 + Х
2О
Реактивност
уредиНитрогванидин постоји у воденој средини у два облика у таутомерној равнотежи један са другим, наиме нитроимино облик (1-нитрогванидин) и нитроамински облик (2-нитрогванидин). I у чврстој фази и у раствору преовлађује имин облик.[24].
- Х
2Н-C(-НХ
2)=Н-НО
2 ⇄ ХН=C(-НХ
2)-НХ-НО
2
Употреба
уредиЕксплозиви
уредиНитрогванидин је у употреби од 1930-их као састојак погонских горива са троструком базом у којима смањује температуру пламена, бљесак отвора и ерозију цеви пиштоља, али задржава притисак у комори због високог садржаја азота. Његова екстремна неосетљивост у комбинацији са ниском ценом учинила га је популарним састојком у неосетљивим високоексплозивним формулацијама (нпр. АФX-453, АФX-760, ИМX-101, АЛ-ИМX-101, ИМX-103, итд.).[25]
Експлозивно распадање нитрогванидина је дато следећом једначином:
- Х4Н4ЦО2 (с) → 2 Х2О (г) + 2 Н2 (г) + C (с)
Нитрогванидин се користи као компонента у праховима са троструком базом, односно на бази нитроцелулозе, нитроглицерина и амино деривата као што је нитрогванидин. Тамо се користи за смањење температуре блица без утицаја на притисак детонације. Нитрогванидин се уграђује као фина суспензија у бездимни прах који садржи нитроцелулозу, нитроглицерин и често централит.[26] Ови прахови су мање енергетски густи од прахова са двоструком базом, али мање еродирају цев пиштоља.[27].
Под овим условима, додатак нитрогванидина у праху омогућава смањење пламена на отвору цеви упркос повећаном стварању дима.[27] · [4].
Нитрогванидин се такође користи у саставу специфичних такозваних пудера ниске осетљивости (ЛОВА).[28] Ова горива не дефлагрирају или детонирају када су подвргнута топлоти или удару или погођена обликованим пуњењем и стога су безбеднија. Нитрогванидин затим замењује експлозиве као што је ХМX и везује се за везиво као што је нитроцелулоза или поливинил нитрат и пластификатори.[29]
Пестициди
уредиДеривати нитрогванидина се користе као инсектициди, који имају упоредиво дејство са никотином. Деривати укључују клотианидин, динотефуран, имидаклоприд и тиаметоксам.
Биохемија
уредиНитрозоиловани дериват, нитрозогванидин, се често користи за мутагеизацију бактеријских ћелија за биохемијске студије.
Структура
уредиНакон неколико деценија дебате, НМР спектроскопијом и дифракцијом рендгенских зрака и неутрона могло би се потврдити да нитрогванидин постоји искључиво као нитроимин таутомер и у чврстом стању и у раствору.[30][31][32]
Референце
уреди- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б в г Ernst-Christian, Koch (2021). High explosives, propellants, pyrotechnics. De Gruyter. стр. 510. ISBN 978-3-11-066052-4.
- ^ а б Thomas M., Klapötke (2022-08-01). Chemistry of High-Energy Materials [Chemistry of High-Energy Materials]. De Gruyter. стр. 516. ISBN 978-3-11-073950-3. doi:10.1515/9783110739503. Приступљено 2023-07-30.
- ^ United Nations, Transport of Nitroguanidine, wetted, (UN 1336) in flexible IBCs, ST/SC/AC.10/C.3/2006/52, Geneva, 13 April 2006. Accessed at https://www.unece.org/fileadmin/DAM/trans/doc/2006/ac10c3/ST-SG-AC10-C3-2006-52e.pdf
- ^ M. W., Kirkwood; George F, Wright (1957-06-01). MECHANISM OF GUANIDINE NITRATION: II. TETRAETHYLNITROGUANIDINE. 35. Canadian Journal of Chemistry. стр. 527—540. ISSN 0008-4042. doi:10.1139/v57-074. Приступљено 2023-07-30. Непознати параметар
|issn2=игнорисан (помоћ) - ^ A, Strecker (1861). Untersuchungen über die chemischen Beziehungen zwischen Guanin, Xanthin, Theobromin, Caffein und Kreatinin. 118. Annalen der Chemie und Pharmacie. стр. 151—177. doi:10.1002/jlac.18611180203.
- ^ Synthesis method of superfine nitroguanidine with particle size of less than 4.0um. 2020-03-24. Приступљено 2023-07-30.
- ^ „Organic Syntheses Procedure”. orgsyn.org. Приступљено 2023-07-30.
- ^ William H., Hill; Robert C., Swain; Joseph H., Paden (1941-08-12). Production of guanidine nitrate. Приступљено 2023-07-30.
- ^ Tenney L., Davis (1922-12-26). Guanidine nitrate. Приступљено 2023-07-30.
- ^ One-step safety production method of guanidine nitrate. 2012-04-11. Приступљено 2023-07-30.
- ^ Axt (1. 8. 2007). „Nitroguanidine: from sulphamic acid and urea”. Sciencemadness Discussion Board.
- ^ E.-C. Koch, Insensitive High Explosives: III. Nitroguanidine – Synthesis – Structure – Spectroscopy – Sensitiveness, Propellants Explos. Pyrotech. 2019, 44, 267-292. [1]
- ^ Ghose, A.K.; Viswanadhan V.N. & Wendoloski, J.J. (1998). „Prediction of Hydrophobic (Lipophilic) Properties of Small Organic Molecules Using Fragment Methods: An Analysis of AlogP and CLogP Methods”. J. Phys. Chem. A. 102: 3762—3772. doi:10.1021/jp980230o.
- ^ Tetko IV, Tanchuk VY, Kasheva TN, Villa AE (2001). „Estimation of Aqueous Solubility of Chemical Compounds Using E-State Indices”. Chem Inf. Comput. Sci. 41: 1488—1493. PMID 11749573. doi:10.1021/ci000392t.
- ^ Ertl P.; Rohde B.; Selzer P. (2000). „Fast calculation of molecular polar surface area as a sum of fragment based contributions and its application to the prediction of drug transport properties”. J. Med. Chem. 43: 3714—3717. PMID 11020286. doi:10.1021/jm000942e.
- ^ а б в E.-C. Koch: Sprengstoffe, Treibmittel, Pyrotechnika. 2., vollständig überarbeitete Auflage. de Gruyter, Berlin, 2019, ISBN 978-3-11-055784-8.
- ^ а б R. Doherty, R. L. Simpson: Comparative Evaluation of several insensitive high explosives, 28th International Annual ICT Conference, June 1997, Karlsruhe, Germany. V-32.
- ^ а б в J. Köhler, R. Meyer, A. Homburg: Explosivstoffe. 10., vollständig überarbeitete Auflage. Wiley-VCH, Weinheim 2008, ISBN 978-3-527-32009-7.
- ^ а б в Ernst-Christian Koch (18. 01. 2019), „Insensitive High Explosives: III. Nitroguanidine – Synthesis – Structure – Spectroscopy – Sensitiveness”, Propellants, Explosives, Pyrotechnics (на језику: немачки), 44 (3), pp. 267–292, doi:10.1002/prep.201800253
- ^ Terry R. Gibbs, Alphonse Popolato (1984), LASL explosive property data (на језику: немачки), University of California Press, pp. 52–60, ISBN 0-520-04012-0}}
- ^ „Nitroguanidine”. National Institutes of Health. Приступљено 10. 06. 2015.
- ^ „Nitroguanidine”. 04. 01. 2012. Приступљено 10. 06. 2015.
- ^ E.-C. Koch, Insensitive High Explosives: IV. Nitroguanidine - Initiation & detonation, Def. Tech. 2019, 15, 467-487.[2]
- ^ ARMY RESEARCH LABORATORY Extraction of Nitroguanidine (NQ) From Triple-Base Gun Propellant by Jeffrey B. Morris February 2002 lire en ligne
- ^ а б Rudolf, Meyer; Josef, Köhler; Axel, Homburg; Rudolf, Meyer (2007). Explosives. Wiley-VCH. стр. 236. ISBN 978-3-527-31656-4. Приступљено 2023-07-30.
- ^ Ernst‐Christian, Koch (20. 01. 2021). Insensitive High Explosives: V. Ballistic Properties and Vulnerability of Nitroguanidine Based Propellants. 46. Propellants, Explosives, Pyrotechnics. стр. 174—206. ISSN 0721-3115. doi:10.1002/prep.202000220. Приступљено 2023-07-30. Непознати параметар
|issn2=игнорисан (помоћ) - ^ Rudolf, Meyer; Josef, Köhler; Axel, Homburg (2007). Explosives. Wiley - VCH Verlag. стр. 211. ISBN 978-3-527-31656-4. Приступљено 2023-07-30.
- ^ Bulusu, S.; Dudley, R. L.; Autera, J. R. (1987). „Structure of nitroguanidine: nitroamine or nitroimine? New NMR evidence from nitrogen-15 labeled sample and nitrogen-15 spin coupling constants”. Magnetic Resonance in Chemistry. 25 (3): 234—238. S2CID 97416890. doi:10.1002/mrc.1260250311.
- ^ Murmann, R. K.; Glaser, Rainer; Barnes, Charles L. (2005). „Structures of nitroso- and nitroguanidine x - ray crystallography and computational analysis”. Journal of Chemical Crystallography. 35 (4): 317—325. S2CID 96090647. doi:10.1007/s10870-005-3252-y.
- ^ S. Choi, Refinement of 2-Nitroguanidine by Neutron Powder Diffraction, Acta Crystallogr. B 1981, 37, 1955-1957.[3]
Literatura
уреди- Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th изд.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
- Katritzky A.R.; Pozharskii A.F. (2000). Handbook of Heterocyclic Chemistry (Second изд.). Academic Press. ISBN 0080429882.