Naftalen
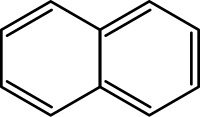
Naftalen je policiklični aren molekulske formule C10H8. On je bela kristalna materija sa karakterističnim mirisom koji se može detektovati pri koncentracijama od 0.08 ppm po masi.[4] Njegova aromatični ugljovodonična struktura se sastoji od kondenzovanih prstena benzena. Naftalen se koristi kao sredstvo protiv moljaca. Naftalen se dobijaja iz nafte.[5]
| |

| |
| Nazivi | |
|---|---|
| IUPAC naziv
bicyclo[4.4.0]deca-1,3,5,7,9-pentene
| |
| Drugi nazivi
Tar kamfor, beli tar, pahuljice za moljce, naftalin, antimit, biciklo[4.4.0]deka-1,3,5,7,9-penten
| |
| Identifikacija | |
3D model (Jmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.001.863 |
| EC broj | 202-049-5 |
| KEGG[1] | |
| RTECS | QJ0525000 |
| UNII | |
| |
| |
| Svojstva | |
| C10H8 | |
| Molarna masa | 128,17052 g/mol |
| Agregatno stanje | Beli kristali/ljuske, jakog mirisa na ugljeni katran |
| Gustina | 1,14 g/cm³ |
| Tačka topljenja | 8.026 °C (14.479 °F; 8.299 K) |
| Tačka ključanja | 218 °C (424 °F; 491 K) |
| Približno 30 mg/L | |
| Opasnosti | |
| Glavne opasnosti | Zapaliv je, sensitizer, mogući karcinogen. Prašina može da formira eksplozivnu smešu sa vazduhom |
| R-oznake | R22, R40, R50/53 |
| S-oznake | (S2), S36/37, S46, S60, S61 |
| NFPA 704 | |
| Tačka paljenja | 79 - 87 °C |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25°C [77°F], 100 kPa). | |
| Reference infokutije | |

Vidi još uredi
Izvori uredi
- ^ Joanne Wixon; Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast. 17 (1): 48—55. doi:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Amoore J E and Hautala E (1983). „Odor as an aid to chemical safety: Odor thresholds compared with threshold limit values and volatiles for 214 industrial chemicals in air and water dilution”. J Appl Toxicology. 3 (6): 272—290. doi:10.1002/jat.2550030603.
- ^ Harvey, Ronald G. Polycyclic Aromatic Hydrocarbons (1997 izd.). Wiley-VCH. ISBN 978-0-471-18608-3.
Literatura uredi
- Harvey, Ronald G. Polycyclic Aromatic Hydrocarbons (1997 izd.). Wiley-VCH. ISBN 978-0-471-18608-3.
