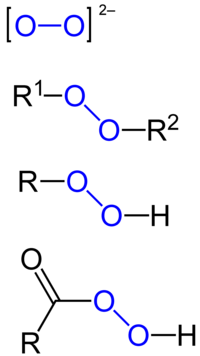
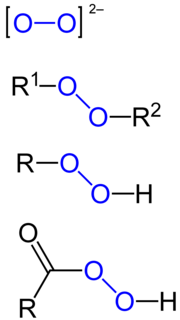
Peroksid
Peroksid je hemijsko jedinjenje hemijskih elemenata sa kiseonikom, u kojem se kiseonik javlja sa oksidacionim brojem -I. Najpoznatiji peroksid je peroksid vodonika.[5][6]
| |
| Nazivi | |
|---|---|
| IUPAC naziv
Peroksid
| |
| Sistemski IUPAC naziv
Dioxidanediide | |
| Drugi nazivi
Dioksid(2-)
| |
| Identifikacija | |
| |
3D model (Jmol)
|
|
| ChEBI |
|
| ChemSpider |
|
| Gmelin Referenca | 486 |
| |
| |
| Svojstva | |
| R−O−O−R' | |
| Molarna masa | 32,00 g·mol−1 |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25°C [77°F], 100 kPa). | |
| Reference infokutije | |
Peroksid barijuma nalazi primenu u pirotehnici. Peroksid natrijuma se koristi za apsorbovanje ugljen-dioksida i regenerator kiseonika (npr. u podmornicama), u sled reakcije:
- 2Na2O2 + 2CO2 → 2Na2CO3 + O2
Neki od najpoznatijih peroksida su:
- H2O2
- Na2O2
- K2O2
- Rb2O2
- Cs2O2
- (NH4)2O2
- MgO2. xH2O
- CaO2
- SrO2
- BaO2
- ZnO2
- CdO2
- HgO2
Takođe postoje i superoksidi, kod kojih se kiseonik javlja sa oksidacionim brojem -½ npr. KO2 - superoksid kalijuma.
Biohemija
urediPeroksidi su obično veoma reaktivni i stoga se pojavljuju u prirodi u veoma malo oblika, među kojima, pored vodonik-peroksida, i neki produkti povrća kao što su askaridol i derivat peroksida prostaglandina. Vodonik-peroksid javlja se na površini vode, u podzemnim vodama i u atmosferi. Formira se pod svetlošću ili nekim drugim katalizatorom. Morska voda sadrži od 0.5 do 14 miligrama po litru vodonik-peroksida, sveža voda od 1 do 30. Vodonik-peroksid formira se u ljudima i životinjama, kao i u kratko živom produktu u biohemijskom procesu i toksičan je za ćelije. Toksičnost potiče od oksidacije proteina i DNK od peroksidnih jona.[7] Klasa bioloških enzima SOD (superoksid dismutaza) stvara se u skoro svim živim ćelijama kao antioksidansi. Oni pomažu razlaganje superoksida u kiseonik i vodonik-peroksid, koji je ubrѕo razložen pomoću enzima katalaze u kiseonik i vodu.[8]
- Formiranje vodonik-peroksida pomoću superoksida dismutaze (SOD)
Peroksizomi su organele koje se nalaze u skoro svim eukariotskim ćelijama.[9] One učestvuju u katabolizmu dugih lanaca masnih kiselina, biosintezi plazmalogena. Prilikom oksidacije, one proizvode vodonik-peroksid.[10]
- FAD = Flavin adenin dinukleoid
Katalaza, još jedan peroksimalni enzim, koristi vodonik-peroksid da oksidira druge substrate, uključujući fenole, metansku (mravlju) kiselinu, formaldehid i alkohol. Ovaj proces takođe otklanja otrovan vodonik-peroksid u toku procesa.
Ova reakcija je važna u ćelijama jetre i bubrega, gde peroksizomi neutrališu razne toksične supstance koje uđu u krv. Jedan deo alkohola (etanola) koji ljudi unesu je oksidiran do acetaldehida na ovaj način. Takođe, kada se vodonik-peroksid nagomila (skupi) u ćeliji, katalaza ga pretvara u vodu u sledećoj reakciji.
Još jedan izvor vodonik-peroksida je degradacija adenozin-monofosfata koji daje hipoksatin. Hipoksatin je zatim katabolizovan do ksantina a onda do urinske kiseline, a katalizator u ovoj reakciji je ksantin oksidaza.
Degradacija guanozina monofosfata daje ksantin kao primarni produkt koji je zatim konvertovan na isti način u urinsku kiselinu sa formacijom vodonik-peroksida.
Jaja morskog ježa, ubrzo nakon što su oplođena, proizvode vodonik-peroksid. On je ubrzo razložen na OH- radikale. Radikali služe kao pokretači radijalne polimerizacije, koja okružuje jaja zaštitnim slojem polimera.
Jedna brsta bube (bombardier beetle na engleskom) može da baca korozivne i smrdljive mehurove na svoje neprijatelje. Buba proizvodi i skladišti hidrohinon i vodonik-peroksid, u dva odvojena rezervoara na zadnjem delu abdomena. Kada je napadnuta, buba grči mišiće koji gurahu dva reaktanta kroz kanale u odeljak koji sadrži vodu i smešu kataličkih enzima. Kada se kombinuju, nastaje burna egzotermna hemijska reakcija, temperatura raste skoro do tačke ključanja vode (100 °C). Ključajuća tečnost neprijatnog mirisa delom postaje gas i izbačena je kroz spoljašnji ventil uz glasan zvuk.
Sinteza vodonik-peroksida
urediNajčešće korišćen metod sinteze vodonik-peroksida je antrahinon proces. Antahinon je prvo hidrogenizovan do antahidrohinona. Ova redukovana komponenta je oksidirana sa molekulima kiseonika, regenerišući antahinon i otpuštajući vodonik-peroksid. Direktna sinteza vodonik-peroksida iz vodonika i kiseonika je neefikasna i trenutno se ne upotrebljava u industriji.
Mnogi peroksidi mineralnih soli, kao što su peroksid-disulfati i perkarbonati, mogu biti dobijeni oksidacijom (pomoću anoda) tih kiselina. Materijal anode mora biti stabilan na visokim potencijalima od nekoliko volti, tako da je uglavnom ili platina ili njene legure.
Peroksidisumporna kiselina je u istoriji korišćena za pravljenje vodonik-peroksida, pomoću metoda razvijenom na početku 20. veka.
Ovaj proces zahteva relativno visoku koncentraciju peroksidisumporne kiseline zato što razblaženiji rastvori stvaraju kiseonik umesto peroksida.
Organski peroksidi
urediOrganski peroksidi mogu biti podeljeni u dve velike grupe, peroksikiseline i organske hidroperokside. Prva grupa se pravi od karboksilnih kiselina a druga od etra ili alkohola.
Pravljenje
urediVećina peroksikiselina mogu se dobiti u reakciji vodonik-peroksida i odgovarajuće karboksilne kiseline.
- R je organska grupa
Drugi način koristi alil (kiselinski) halid umesto karboksilne kiseline. Ovaj način se koristi najviše sa aromatičnim jedinjenjima u bazi da bi se neutralizovao dobijeni hlorovodonik.
Aromatični aldehidi mogu biti auto-oksidirani u peroksikarboksilnu kiselinu.
- Ar je aril
Produkti međutim deluju sa početnim adehidom gradeći karboksilnu kiselinu.
Poznato je nekoliko načina za sintezu alifatičnih peroksida, kao što je reakcija dialkil-sulfata sa alkalnim rastvorom vodonik-peroksida.[11][12] Ovim metodom, alkil-sulfat daje alkil grupu i sulfatni jon formira napuštajuću grupu (?).
Analiza peroksida
urediZa kvalitativno i kvantitativno određivanje peroksida koristi se nekoliko analitičkih metoda.[13] Jednostavna kvalitativna detekcija peroksida se vrši jodno-skrobnom reakcijom.[14] Ovde peroksidi, hidroperoksidi ili perkiseline oksiduju dodati kalijum jodid u jod, koji reaguje sa skrobom dajući tamnoplavu boju. Dostupni su indikatori komercijalnog papira koji koriste ovu reakciju. Ova metoda je takođe pogodna za kvantitativnu procenu, ali ne može da razlikuje različite vrste peroksidnih jedinjenja. Umesto toga, za ovu svrhu se koristi promena boje različitih indigo boja u prisustvu peroksida.[15] Na primer, gubitak plave boje u leuko-metilen plavo je selektivan za vodonik peroksid.[16]
Kvantitativna analiza hidroperoksida može se izvršiti potenciometrijskom titracijom sa litijum aluminijum hidridom.[17] Drugi način da se proceni sadržaj perkiselina i peroksida je volumetrijska titracija sa alkoksidima kao što je natrijum etoksid.[18]
Aktivni kiseonik u peroksidima
urediSmatra se da svaka peroksi grupa sadrži jedan aktivni atom kiseonika. Koncept sadržaja aktivnog kiseonika je koristan za poređenje relativne koncentracije peroksi grupa u formulacijama, što je povezano sa energetskim sadržajem. Generalno, sadržaj energije se povećava sa sadržajem aktivnog kiseonika, i samim tim što je veća molekulska težina organskih grupa, to je niži energetski sadržaj i, obično, manja opasnost.
Termin aktivni kiseonik se koristi za određivanje količine peroksida prisutnog u bilo kojoj formulaciji organskog peroksida. Jedan od atoma kiseonika u svakoj peroksidnoj grupi se smatra „aktivnim”. Teorijska količina aktivnog kiseonika može se opisati sledećom jednačinom:[19]
gde je p broj peroksidnih grupa u molekulu, a m je molekulska masa čistog peroksida.
Bezbednost
urediPeroksidi su jaki oksidansi i lako reaguju sa kožom, pamukom i drvenom pulpom.[20] Iz bezbednosnih razloga, peroksidna jedinjenja se čuvaju u hladnom, neprozirnom kontejneru, jer zagrevanje i osvetljenje ubrzavaju njihove hemijske reakcije. Male količine peroksida, koje izlaze iz rezervoara za skladištenje ili reakcionih sudova, neutrališu se korišćenjem redukcionih agenasa kao što je gvožđe(II) sulfat. Mere bezbednosti u industrijskim postrojenjima koja proizvode velike količine peroksida uključuju sledeće:
- Oprema se nalazi unutar armiranobetonskih konstrukcija sa prozorima od folije, koji bi smanjili pritisak i ne bi došlo do loma u slučaju eksplozije.
- Proizvodi se flaširaju u male kontejnere i premeštaju se na hladno mesto odmah nakon sinteze.
- Kontejneri su napravljeni od nereaktivnih materijala kao što su nerđajući čelik, neke legure aluminijuma ili tamno staklo.[21]
Za bezbedno rukovanje koncentrovanim organskim peroksidima, važan parametar je temperatura uzorka, koju treba održavati ispod temperature samoubrzajućeg razlaganja jedinjenja.[22]
Transport organskih peroksida je ograničen. Ministarstvo saobraćaja SAD navodi ograničenja isporuke organskog peroksida i zabranjene materijale u tabeli opasnih materijala 49 CFR 172.101 na osnovu koncentracije i fizičkog stanja materijala:
| Hemijski naziv | CAS broj | Zabrana |
|---|---|---|
| Acetil aceton peroksid | 37187-22-7 | > 9% po masi aktivnog kiseonika |
| Acetil benzoil peroksid | 644-31-5 | čvrst, ili > 40% u rastvoru |
| Askaridol | 512-85-6 | (organski peroksid) |
| tert-Butil hidroperoksid | 75-91-2 | > 90% u rastvoru (vodenom) |
| Di-(1-naftoil)peroksid | 29903-04-6 | |
| Diacetil peroksid | 110-22-5 | čvrst, ili > 25% u rastvoru |
| Etil hidroperoksid | 3031-74-1 | |
| Metil etil keton peroksid | 1338-23-4 | > 9% po masi aktivnog kiseonika u rastvoru |
| Metil izobutil keton peroksid | 37206-20-5 | > 9% po masi aktivnog kiseonika u rastvoru |
Reference
uredi- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I izd.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th izd.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
- ^ Herbert Klenk (2005). „Peroxy Compounds, Organic”. Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_199.
- ^ Silbert, L. S.; Siegel, E.; Swern, D. (1964). „Peroxybenzoic Acid”. Org. Synth. 44: 81. doi:10.15227/orgsyn.044.0081.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. izd.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ Holleman A. F.; Wiberg E. (2001). Inorganic Chemistry (1st izd.). San Diego: Academic Press. ISBN 0-12-352651-5.
- ^ Löffler G. and Petrides, P. E. Physiologische Chemie. 4 ed. str. 288, Springer, Berlin. ISBN 978-3-540-18163-7 (in German)
- ^ Löffler G. and Petrides, P. E. Physiologische Chemie. 4 ed. str. 321-322, Springer, Berlin 1988. 1988. ISBN 978-3-540-18163-7. (in German)
- ^ Gabaldón T. (2010). „Peroxisome diversity and evolution”. Philos Trans R Soc Lond B Biol Sci. 365 (1541): 765—73. PMC 2817229 . PMID 20124343. doi:10.1098/rstb.2009.0240.
- ^ Nelson & Cox 2005, str. 663–664
- ^ Medwedew, S. S.; Alexejewa, E. N. (1932). „Organic peroxides II. Of the reaction between benzoyl hydroperoxide or benzoyl peroxide and triphenylmethyl”. Berichte der deutschen chemischen Gesellschaft (A and B Series). 65 (2): 137. doi:10.1002/cber.19320650204.
- ^ Wiley, Richard Haven "Preparation of diaikyl peroxides" U.S. Patent 2.357.298 Issue date: 1942
- ^ Légrádi, L.; Légrádi, J. (1970). „Detection of peroxides, hydroperoxides and peracids”. Microchimica Acta. 58: 119—122. S2CID 101877371. doi:10.1007/BF01218105.
- ^ Lea, C. H. (1931). „The Effect of Light on the Oxidation of Fats”. Proceedings of the Royal Society B: Biological Sciences. 108 (756): 175—189. Bibcode:1931RSPSB.108..175L. doi:10.1098/rspb.1931.0030 .
- ^ Veibel, S. Analytik organischer Verbindungen, Akademie-Verlag, Berlin, 1960, p. 262
- ^ Eiss, M. I.; Giesecke, Paul (1959). „Colorimetric Determination of Organic Peroxides”. Analytical Chemistry. 31 (9): 1558. doi:10.1021/ac60153a038.
- ^ Higuchi, T.; Zuck, Donald Anton (1951). „Behaviors of Several Compounds as Indicators in Lithium Aluminum Hydride Titration of Functional Groups”. Journal of the American Chemical Society. 73 (6): 2676. doi:10.1021/ja01150a073.
- ^ Martin, A. J. (1957). „Potentiometric titration of hydroperoxide and peracid in Anhydrous Ethylenediamine”. Analytical Chemistry. 29: 79—81. doi:10.1021/ac60121a022.
- ^ „ASTM E298, Standard Test Methods for Assay of Organic Peroxides”. ASTM. 2010.
- ^ Heinz G. O. Becker Organikum, Wiley-VCH, 2001, ISBN 3-527-29985-8 pp. 741–762
- ^ Ozonelab Peroxide compatibility
- ^ „Product Stewardship”. American Chemistry Council. 2021-01-17. Pristupljeno 2022-01-03.
Literatura
uredi- Nelson, David L.; Cox, Michael M. (2005). Lehninger Biochemie. Springer. str. 663—664. ISBN 978-3-540-41813-9.
- Creaser, I.I.; Edwards, J.O. (1972). „?”. Topics in phosphorus chemistry. 7: 379—435.
- Chen, Li-Jiang; Lin, Chang-Jian; Zuo, Juan; Song, Ling-Chun; Huang, Chao-Ming (2004). „First Spectroscopic Observation of Peroxocarbonate/ Peroxodicarbonate in Molten Carbonate”. The Journal of Physical Chemistry B. 108 (23): 7553—7556. doi:10.1021/jp035749l.
- „The Perils of Peroxides”. carolina.com. Burlington, NC: Carolina Biological Supply Company. Arhivirano iz originala 2007-12-18. g.
Spoljašnje veze
uredi- Mediji vezani za članak Peroksid na Vikimedijinoj ostavi
- Organic Peroxide Producers Safety Division
- OSH Answers – organic peroxides
- European Organic Peroxide Safety Group