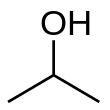
Izopropil alkohol
Izopropil alkohol (Izopropanol, propan-2-ol, 2-propanol, IPA) je ime hemijskog jedinjenja sa molekulskom formulom C3H8O. On je bezbojna, zapaljiva materija jakog mirisa. On je najjednostavniji primer sekundarnih alkohola, kod kojih je alkoholni ugljenik vezan za dva druga ugljenika, (CH3)2CHOH. On je strukturni izomer propanola.
| |||
| Nazivi | |||
|---|---|---|---|
| IUPAC naziv
isopropyl alcohol
| |||
| Preferisani IUPAC naziv
propan-2-ol | |||
| Drugi nazivi
2-propanol, izopropanol, izopropil alkohol, iPrOH
| |||
| Identifikacija | |||
3D model (Jmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.601 | ||
| KEGG[1] | |||
| RTECS | NT8050000 | ||
| UNII | |||
| UN broj | 1219 | ||
| |||
| Svojstva | |||
| C3H8O | |||
| Molarna masa | 60,10 g·mol−1 | ||
| Agregatno stanje | bezbojna tečnost | ||
| Gustina | 0,786 g/cm3 (20 °C) | ||
| Tačka topljenja | −89 °C (−128 °F; 184 K) | ||
| Tačka ključanja | 825 °C (1.517 °F; 1.098 K) | ||
| meša se | |||
| Rastvorljivost | meša se sa benzenom, hloroformom, etanolom, etrom, glicerinom rastvoran je u acetonu nerastvoran je u slanim rastvorima | ||
| Kiselost (pKa) | 16.5 | ||
| Indeks refrakcije (nD) | 1.3776 | ||
| Viskoznost | 2.86 cP na 15 °C 1.96 cP na 25 °C[4] 1.77 cP na 30 °C Za 187K-500K, viskozitet (cP) = 10^(-0.7009+(8.4150E+02/T)+(-8.6068E-03*T)+(8.2964E-06*(T^2))) (Temp u K)[4] | ||
| Dipolni moment | 1.66 D (gas) | ||
| Opasnosti | |||
| Opasnost u toku rada | Zapaljiv | ||
| Bezbednost prilikom rukovanja | External MSDS | ||
| GHS grafikoni |  
| ||
| GHS signalna reč | Opasnost | ||
| H225, H319, H336 | |||
| P210, P261, P305+351+338 | |||
EU klasifikacija (DSD)
|
Visoko zapaljiv (F), iritant (Xi) | ||
| R-oznake | R11 R36 R67 | ||
| S-oznake | S7 S16 S24 S25 S26 | ||
| NFPA 704 | |||
| Tačka paljenja | Open cup: 117 °C (243 °F; 390 K) Zatvorena posuda: 13 °C (55 °F) | ||
| 399 °C (750 °F; 672 K) | |||
| Eksplozivni limiti | 2–12.7% | ||
| 980 mg/m³ (TWA), 1225 mg/m³ (STEL) | |||
| Letalna doza ili koncentracija (LD, LC): | |||
LD50 (LD50)
|
12800 mg/kg (dermalno, zec) 3600 mg/kg (oralno, miš) 5045 mg/kg (oralno, pacov) 6410 mg/kg (oralno, zec)[6] | ||
LC50 (LC50)
|
53000 mg/m³ (inhalacija, miš) 12,000 ppm (pacov, 8 hr)[6] | ||
LCLo (LCLo)
|
16,000 ppm (pacov, 4 hr) 12,800 ppm (miš, 3 hr)[6] | ||
| SAD zdravstvene granice izlaganja (NIOSH): | |||
PEL (dozvoljivo)
|
TWA 400 ppm (980 mg/m³)[5] | ||
REL (preporučeno)
|
TWA 400 ppm (980 mg/m³) ST 500 ppm (1225 mg/m³)[5] | ||
IDLH (neposredna opasnost)
|
2000 ppm[5] | ||
| Srodna jedinjenja | |||
Srodne materije: alkoholi
|
1-Propanol, Etanol, 2-Butanol | ||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |||
| Reference infokutije | |||
Osobine
уредиIzopropil alkohol se može oksidovati do acetona. To se može postići koristeći oksidacione agense kao što je hromna kiselina, ili putem dehidrogenacije izopropil alkohola nad zagrejanim bakarnim katalizatorom:
Izopropil alkohol se često koristi kao rastvarač i izvor hidrida. Izopropil alkohol se može konvertovati u 2-bromopropan koristeći fosfor tribromid, ili dehidrisan do propena zagrevanjem sa sumpornom kiselinom.
Poput većine alkohola, izopropil alkohol reaguje sa aktivnim metalima kao što je kalijum do formira alkokside, koji se nazivaju izopropoksidi. Reakcija sa aluminijumom (inicirana tragovima žive) se koristi za pripremu katalizatora aluminijum izopropoksid.[7]
Reference
уреди- ^ Joanne Wixon; Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast. 17 (1): 48—55. doi:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б Yaws, C.L. (1999). Chemical Properties Handbook. McGraw-Hill. ISBN 978-0-07-073401-2.
- ^ а б в NIOSH Džepni vodič hemijskih hazarda 0359
- ^ а б в „Isopropyl alcohol”. Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ^ Young, W.; Hartung, W.; Crossley, F. (1936). „Reduction of Aldehydes with Aluminum Isopropoxide”. J. Am. Chem. Soc. 58: 100—2. doi:10.1021/ja01292a033.
Literatura
уреди- Yaws, C.L. (1999). Chemical Properties Handbook. McGraw-Hill. ISBN 978-0-07-073401-2.
Spoljašnje veze
уреди- Zdravstvene smernice
- MSDS za izopropil alkohol Архивирано на сајту Wayback Machine (2. децембар 2011)