Kataliza
Kataliza je proces povećanja brzine hemijske reakcije dodavanjem supstance poznate kao katalizator.[1][2] Drugim rečima, katalizator je hemijska supstancija, koja se dodaje reakcionom sistemu da bi ubrzala reakciju.[3][4][5] Katalizatori se ne troše u katalizovanoj reakciji, ali mogu delovati više puta. Često su potrebne samo vrlo male količine katalizatora.[6] Globalna potražnja za katalizatorima u 2010. procenjena je na približno 29,5 milijardi američkih dolara.[7]
Tehnička perspektiva
urediU prisustvu katalizatora, manje slobodne energije je neophodno da se postigne prelazno stanje, dok se totalna slobodna energija od reaktanata do proizvoda ne menja.[1] Katalizator može da učestvuje u višestrukim hemijskim transformacijama. Efekat katalizatora može da varira usled prisustva drugih supstanci poznatih kao inhibitori ili otrovi (koje redukuju katalitičku aktivnost), ili promotori (koji povećavaju aktivnost). Materija sa suprotnim dejstvom od katalizatora, supstanca koja redukuje brzinu reakcije, je inhibitor.[1]
Katalizovane reakcije imaju nižu energiju aktivacije (slobodnu energiju aktivacije koja ograničava brzinu) nego korespondirajuće nekatalizovane reakcije, što dovodi do većih brzina reakcije na datoj temperaturi i koncentracijama reaktanata. Međutim, detaljna mehanika katalize je kompleksna. Katalizatori mogu povoljno da utiču na reakciono okruženje, ili da vežu reagense i poarizuju veze, npr. kiseli katalizatori za reakcije karbonilnih jedinjenja, ili da formiraju specifične intermedijere koji se prirodno ne formiraju, kao što su osmijumski estri u osmijum tetroksidom katalizovanoj dihidroksilaciji alkena, ili da uzrokuju disocijaciju reagenasa do reaktivnih formi, kao što je hemisorbovani vodonik i katalitičkoj hidrogenaciji.
Kinetički, katalitičke reakcije su tipične hemijske reakcije; tj. brzina reakcije zavisi od učestalosti kontakta reaktanata u koraku koji određuje brzinu. Obično, katalizator učestvuje u tom najsporijem koraku, i brzine su ograničene količinom katalizatora i njegovom „aktivnošću“. U heterogenoj katalizi, difuzija reagenasa do porvšine i difuzija produkata sa površine mogu da određuju brzinu. Katalizator baziran na nanomaterijalu je primer heterogenog katalizatora. Analogni događaji vezani za vezivanje substrata i disocijaciju produkta važe za homogenu katalizu.
Mada se katalizatori ne troše u samoj reakciji, može da dođe do njihove inhibicije, deaktivacije, ili uništenja sekundarnim procesima. U heterogenoj katalizi, tipični sekundarni proces je koking, pri kome katalizator postaje pokriven polimernim nusproduktima. Dodatno, može doći do rastvaranja heterogenih katalizatora u sistemu sa čvstom i tečnom fazom ili sublimacije u čvrstom-gasovitom sistemu.
Zaleđina
urediProdukcija većine industrijski važnijih hemikalija obuhvata katalizatore. Slično tome, većina biohemijski značajnih procesa je katalizovana. Istraživanje katalize je značajno polje primenjene nauke koje obuhvata mnoge oblasti hemije, kao što su organometalna hemija i nauka o materijalima. Kataliza je relevantna za mnoge aspekte nauke o životnoj sredini, e.g. za katalitički konverter u automobilima i za dinamiku ozonskih rupa. Katalitičke reakcije su preferentne u ekološki nastrojenoj zelenoj hemiji, zbog umanjenih količina generisanog otpada,[8] za razliku od stehiometrijskih reakcija u kojima se svi reaktanti konzumiraju i više nusproizvoda se formira. Najzastupljeniji katalizator je jon vodonika (H+). Mnogi prelazni metali i kompleksi prelaznih metala se isto tako koriste u katalizi. Katalizatori zvani enzimi su važni u biologiji.
Katalizator deluje putem pružanja alternativnog reaktivnog puta do reakcionog produkta. Brzina reakcije se povećava pošto ta alternativna ruta ima nižu energiju aktivacije od reakcionog puta koji nije posredovan katalizatorom. Disproporcionacijom vodonik peroksida kreira se voda i kiseonik, kao što je prikazano ispod.
- 2 H2O2 → 2 H2O + O2
Ova reakcija je preferentna u smislu da su reakcioni produkti stabilniji od polaznog materijala, mada je nekatalizovana reakcija spora. Zapravo, dekompozicija vodonik peroksida je toliko spora da su vodeni rastvori vodonik peroksida komercijalno dostupni. Na ovu reakciju moćno utiču katalizatori kao što je mangan dioksid, ili enzim peroksidaza u organizmima. Nakon adicije male količine mangan dioksida, vodonik peroksid brzo reaguje. Taj efekat se lako može zapaziti po otpuštanju mehura kiseonika.[9] Mangan dioksid se ne konzumira u reakciji, i može se povratiti u nepromenjenom stanju, i ponovno koristiti.[10]
Opšti principi
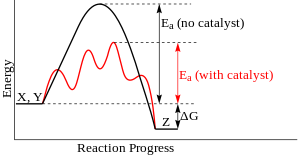
urediReakcija bez katalizatora:
Reakcija sa katalizatorom:
Mehanizam delovanja katalizatora je takav da on smanjuje energiju aktivacije (energiju potrebnu dovesti spolja sistemu da bi došlo de reakcije) gradeći sa reaktantima prelazni kompleks (u datom primeru to bi bio nestabilni [ABK] kompleks) manjeg energetskog sadržaja nego što je on za prelazni kompleks reaktanata bez vezanog katalizatora. Kako je put krive na odgovarajućem energetskom dijagramu kraći i sama reakcija je brža iako će energija konačnih proizvoda biti ista za katalizovanu i za nekatalizovanu reakciju.
Katalizator ne utiče na položaj povratne reakcije, jer u istom stepenu ubrzava reakciju u oba smera. Katalizator samo ubrzava postizanje termodinamičke ravnoteže. Katalizator može da poveća selektivnost reakcije ukoliko ubrzava stvaranje glavnog produkta, a ne ubrzava (ili manje ubrzava) sporedne reakcije. Iako učestvuje u hemijskoj reakciji, katalizator posle završene reakcije ostaje hemijki nepromenjen, ali može doći do fizičke promene (npr. promena agregatnog stanja).
Posebno važna grupa katalizatora su biokatalizatori odnosno enzimi koje katalizuju biohemijske reakcije u organizmima. Enzimi su posebno efikasni katalizatori specifičnog dejstva. To znači da deluju na tačno određenu supstancu (supstrat), katalizujući tačno određenu reakciju koju ubrzavaju i nekoliko hiljada puta.
Tvrdnja koja se javlja u nekim školskim udžbenicima da katalizator nema udeo u hemijskoj reakciji je potpuno netačna.
Jedinice
urediKatalitička aktivnost se obično označava simbolom z[11] i meri se u mol/s, jedinici koja se naziva katal i čime se definiše SI jedinica za katalitičku aktivnost od 1999. godine. Katalitička aktivnost nije tip reakcione brzine, nego svojstvo katalizatora pod određenim uslovima, u kontekstu specifične hemijske reakcije. Katalitička aktivnost od jednog katala (Simbol 1 kat = 1 mol/s) katalizatora označava količinu katalizatora (supstance u molovima) koja dovodi do neto reakcije od jednog mola u sekondi reaktanta, do rezultujućeg reagensa, ili drugog išoda koji se ostvaruje tom hemijskom reakcijom. Katalizatorm može da i obično ima različitu katalitičku aktivnost za različite reakcije.
Postoje dodatne izvedene SI jedinice vezane za katalitičku aktivnost; pogledajte gornju referencu za detalje.
Tipični mehanizam
urediKatalizatori generalno reaguju sa jednim ili više reaktanata i formiraju intermedijere, koji zatim daju finalne reakcione produkte, čime se regeneriše katalizator. Ovo je tipična reakciona šema, gde C predstavlja katalizator, X u Y su reaktanti, a Z je produkt reakcije X i Y:
- X + C → XC (1)
- Y + XC → XYC (2)
- XYC → CZ (3)
- CZ → C + Z (4)
Mada se katalizator konzumira u reakciji 1, on se naknadno formira u reakciji 4, tako da se ne javlja u sveukupnoj reakcionoj jednačini:
- X + Y → Z
Pošto je katalizator regenerisan u reakciji, često su samo male količine neophodne da bi se povećala brzina reakcije. U praksi, međutim, ponekad dolazi do konzumiranja katalizatora u sekundarnim procesima.
Katalizator se obično ne javlja u jednačini brzine. Na primer, ako je korak koji određuje brzinu u gornjoj reakcionoj šemi prvi korak, X + C → XC, katalizovna reakcija će biti drugog reda sa jednačinom brzine v = kcat[X][C], koja je proporcionalna koncentraciji katalizatora [C]. Međutim [C] ostaje konstantan tokom reakcije tako da je katalizovana reakcija pseudo-prvog reda: v = kobs[X], gde je kobs = kcat[C].
Kao jedan primer detaljnog mehanizma na mikroskopskom nivou, 2008. godine su danski istraživači prvi otkrili sekvencu događaja kad se kiseonik i vodonik kombinuju na površini titanijum dioksida (TiO2, ili titanija) da proizvedu vodu. Pomoću serije usporenih snimaka skanirajućom tunelnom mikroskopijom, oni su odredili da molekuli podležu adsorpciji, disocijaciji i difuziji pre nego što reaguju. Intermedijarna reakciona stanja su: HO2, H2O2, zatim H3O2 i konačni reakcioni produkt (dimeri molekula vode), nakon čega se molekul vode desorbuje iz površine katalizatora.[12][13]
Reakciona energetika
urediKatalizatori deluju tako što pružaju (alternativni) mehanizam u kome se javlja različito prelazno stanje i niža energija aktivacije. Konsekventno, veći broj molekulskih kolizija ima neophodnu energiju da dosegne do prelaznog stanja. Katalizatori mogu da omoguće odvijanje reakcija koje bi inače bile blokirane ili usporene kinetičkom barijerom. Katalizotor može da poveća brzinu reakcije ili selektivnost, ili da omogući odvijanje reakcije na nižim temperatura. Taj efekat se može ilustrovati dijagramom energetskog profila.
U katalizovanoj elementarnoj reakciji, katalizatori ne menjaju sveukopni prinos reakcije: oni ne utiču na hemijsku ravnotežu reakcije, pošto u jednakoj meri utiču na brzine direktne i povratne reakcije (pogledajte isto tako termodinamiku). Drugi zakon termodinamike opisuje zašto katalizator ne menja hemijsku ravnotežu reakcije. Pretpostavimo da postoji takav katalizator koji pomera ravnotežu. Uvođenje katalizatora u sistem bi dovolo do pomeranja reakcije do nove reavnoteže, čime se proizvodi energija. Produkcija energije je neophodna pošto su reakcije spontane ako i samo ako se oslobađa Gibsova slobodna energija, a ako nema energetske barijere, nema ni potrebe za katalizatorom. Dalje, uklanjanje katalizatora takođe može da dovede do reakcije, proizvodeći energiju; tj. adicija i njen reverzni proces, bi obe proizvodile energiju. Stoga, katalizator koji menja ravnotežu bi bio mašina perpetualnog kretanja, kontradikcija zakonima termodinamike.[14]
Ako katalizator menja ravnotežu, onda se on mora konzumirati sa tokom reakcije, i stoga je isto tako reaktant. Ilustracija toga je bazom katalizovana hidrolizaestara, u kojoj proizvedena karboksilna kiselina odmah reaguje sa katalizatorom i stoga se reakciona ravnoteža pomera ka hidrolizi.
SI izvedena jedinica za merenje katalitičke aktivnosti katalizatora je katal, tj. mol po sekundi. Produktivnost katalizatora se može opisati brojem preokreta (TON - engl. turn over number),[15] a katalitička aktivnost frekvencijom preokreta (TOF - engl. turn over frequency), koja je TON po jedinici vremena. Biohemijski ekvivalent je enzimska jedinica.[16]
Katalizator stabilizuje prelazno stanje u većoj meri nego što stavilizuje početni materijal. On snižava kinetičku barijeru snižavanjem razlike energije izmežu početnog materijala i prelaznog stanja. On ne menja energetsku razliku između početnog materijala i produkata (termodonamičku barijeru), ili dostupnu energiju (ona dolazi iz okruženja u obliku toplote ili svetlosti).
Vidi još
urediReference
uredi- ^ a b v „Catalyst”. IUPAC Compendium of Chemical Terminology. Oxford: Blackwell Scientific Publications. 2009. ISBN 978-0-9678550-9-7. doi:10.1351/goldbook.C00876.
- ^ Masel, Richard I.: Chemical Kinetics and Catalysis. Wiley-Interscience, New York. 2001. ISBN 0-471-24197-0.
- ^ House, James E. (13. 9. 2007). Principles of Chemical Kinetics, Second Edition (2. izd.). Academic Press. ISBN 978-0-12-356787-1.
- ^ Steinfeld, Jeffrey I.; Francisco, Joseph S.; Hase, William L. (20. 8. 1998). Chemical Kinetics and Dynamics (2. izd.). Prentice Hall. ISBN 978-0-13-737123-5.
- ^ Masel, Richard I. “Chemical Kinetics and Catalysis” Wiley-Interscience. . New York. 2001. ISBN 978-0-471-24197-3.
- ^ 7 things you may not know about catalysis Louise Lerner, Argonne National Laboratory (2011)
- ^ „Market Report: Global Catalyst Market” (2nd изд.). Acmite Market Intelligence.
- ^ „The 12 Principles of Green Chemistry”. United States Environmental Protection Agency. Приступљено 2012-04-30.
- ^ „Genie in a Bottle”. University of Minnesota. 2005-03-02.
- ^ Richard I. Masel “Chemical Kinetics and Catalysis” Wiley-Interscience, New York. 2001. ISBN 0-471-24197-0..
- ^ Dybkaer, R. (2001). „UNIT "KATAL" FOR CATALYTIC ACTIVITY (IUPAC Technical Report)”. Pure Appl. Chem. 73 (6): 929. doi:10.1351/pac200173060927.
- ^ Jacoby, Mitch (16. 2. 2009). „Making Water Step by Step”. Chemical & Engineering News. str. 10.
- ^ Matthiesen J, Wendt S, Hansen JØ, Madsen GK, Lira E, Galliker P, Vestergaard EK, Schaub R, Laegsgaard E, Hammer B, Besenbacher F (2009). „Observation of All the Intermediate Steps of a Chemical Reaction on an Oxide Surface by Scanning Tunneling Microscopy”. ACS Nano. 3 (3): 517—526. ISSN 1520-605X. PMID 19309169. doi:10.1021/nn8008245.
- ^ A.J.B. Robertson Catalysis of Gas Reactions by Metals. Logos Press, London, 1970.
- ^ Hagen, J. (2006). Industrial Catalysis: A Practical Approach. Weinheim, Germany: Wiley-VCH.
- ^ . Nomenclature Committee of the International Union of Biochemistry (NC-IUB). „Units of Enzyme Activity”. Eur. J. Biochem. 97 (2): 319—20. 1979. doi:10.1111/j.1432-1033.1979.tb13116.x.
Literatura
uredi- House, James E. (13. 9. 2007). Principles of Chemical Kinetics, Second Edition (2. izd.). Academic Press. ISBN 978-0-12-356787-1.
- Steinfeld, Jeffrey I.; Francisco, Joseph S.; Hase, William L. (20. 8. 1998). Chemical Kinetics and Dynamics (2. izd.). Prentice Hall. ISBN 978-0-13-737123-5.
- B. Cornils, Wolfgang A. Herrmann, M. Muhler, C. Wong: Catalysis from A to Z: A Concise Encyclopedia. Verlag Wiley-VCH. 2007. ISBN 978-3-527-31438-6..
- J. Hagen: Technische Katalyse. Eine Einführung. Wiley-VCH. 1996. ISBN 978-3-527-28723-9..
- Manfred Baerns: Basic Principles in Applied Catalysis. Springer, Berlin . 2004. ISBN 3-540-40261-6..
- A. Behr (2008). Angewandte homogene Katalyse. Wiley-VCH Verlag. ISBN 978-3-527-31666-3..
- D. Steinborn: Grundlagen der metallorganischen Komplexkatalyse. Vieweg+Teubner. 2007. ISBN 978-3-8351-0088-6..
- P. Kripylo, K.-P. Wendlandt, F. Vogt: Heterogene Katalyse in der chemischen Technik. Deutscher Verlag für Grundstoffindustrie, Leipzig . 1993. ISBN 3-342-00666-8..
- Gabor A. Somorjai (1994). Introduction to Surface Chemistry and Catalysis. New York: Wiley. ISBN 0-471-03192-5.
- Gerhard Ertl, Helmut Knözinger, Ferdi Schüth, Jens Weitkamp: Handbook of Heterogeneous Catalysis. Wiley-VCH, Weinheim . 2008. ISBN 978-3-527-31241-2..
- Gerhard Ertl: Reaktionen an Oberflächen: vom Atomaren zum Komplexen (Nobel-Vortrag). (englisch) (PDF-Datei; 666 kB)
- G. E. Jeromin, M. Bertau: Bioorganikum: Praktikum der Biokatalyse. Wiley-VCH. 2005. ISBN 3-527-31245-5..
Spoljašnje veze
uredi- Science Aid: Catalysts Page for high school level science
- W.A. Herrmann Technische Universität presentation Архивирано на сајту Wayback Machine (28. октобар 2005)
- Alumite Catalyst, Kameyama-Sakurai Laboratory, Japan
- Inorganic Chemistry and Catalysis Group, Utrecht University, The Netherlands
- Centre for Surface Chemistry and Catalysis Архивирано на сајту Wayback Machine (5. октобар 2008)
- Carbons & Catalysts Group, University of Concepcion, Chile
- Center for Enabling New Technologies Through Catalysis, An NSF Center for Chemical Innovation, USA
- "Bubbles turn on chemical catalysts" Архивирано на сајту Wayback Machine (22. јул 2012), Science News magazine online, April 6, 2009.