Tautomer
Tautomeri su izomeri (konstitucioni izomeri) organskih jedinjenja koji se lako konvertuju iz jednog u drugi oblik hemijskom reakcijom zvanom tautomerizacija.[1][2] Ta reakcija obično dovodi do formalne migracije atoma vodonika ili protona, što se ostvaruje zamenom jednostruke veze i susedne dvostruke veze. Koncept tautomerizacije se naziva tautomerizam. Zbog brze interkonverzije, tautomeri se generalno smatraju istim hemijskim jedinjenjem. Tautomerizam je specijalni slučaj strukturnog izomerizma i može da ima važnu ulogu u nekanoničkom baznom sparivanju u DNK, a posebno RNK molekulima.
Hemija
urediU rastvorima u kojima je tautomerizacija moguća, ostvaruje se hemijska ravnoteža tautomera. Precizan odnos tautomera zavisi od nekoliko faktora, uključujući temperaturu, rastvarač, i pH.[3]
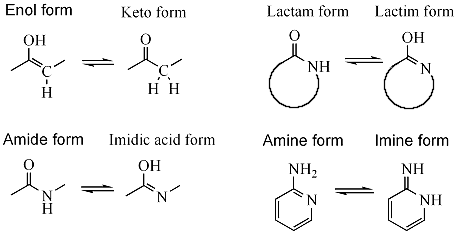
Uobičajeni tautomerni parovi su:
- keton - enol, e.g., za aceton (keto-enolni tautomerizam)
- keten - inol, e.g., for etenon
- amid - imidinska kiselina, e.g., tokom reakcije nitrilne hidrolize
- laktam - laktim, tautomerizam amid - imidinska kiselina u heterocikličnim prstenovima, e.g., u nukleobaza guanin, timin, i citozin
- enamin - imin
- anomeri redukujućih šećera u rastvoru se interkonvertuju putem intermedijarnog oblika otvorenog lanca.
Prototropija
urediPrototropija je najčešči oblik tautomerije. On se odnosi se na premeštanje protona.[4] Prototropni tautomerizam se može smatrati podskupom kiselo-baznog ponašanja. Prototropni tautomeri su skupovi izomernih protonacionih stanja sa istom empirijskom formulom i totalnim naelektrisanjem.
Tautomerizacije se katalizuju:
- Bazama (1. deprotonacija; 2. formiranje delokalizovanog anjon (e.g., enolata); 3. protonacija na različitoj poziciji anjona).
- Kiselinama (1. protonacija; 2. formiranje delokalizovanog katjona; 3. deprotonacija na različitoj poziciji pored katjona).
- Anularni tautomerizam
- tip prototropnog tautomerizma, gde proton može da zauzima dve ili više pozicija na heterocikličnom sistemu, na primer, 1H- i 3H-imidazol; 1H-, 2H- i 4H- 1,2,4-triazol; 1H- i 2H- izoindol.[3]
Reference
uredi- ^ Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th изд.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
- ^ Katritzky A.R.; Pozharskii A.F. (2000). Handbook of Heterocyclic Chemistry (Second изд.). Academic Press. ISBN 0080429882.
- ^ а б Balabin, Roman M. (2009). „Tautomeric equilibrium and hydrogen shifts in tetrazole and triazoles: Focal-point analysis and ab initio limit”. Journal of Chemical Physics. 131 (15): 154307. Bibcode:2009JChPh.131o4307B. doi:10.1063/1.3249968.
- ^ IUPAC Gold Book tautomerism