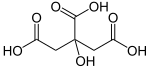
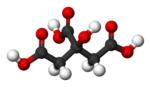
Лимунска киселина
Лимунска киселина, C6H8O7, тробазна је органска киселина[12][13], присутна у многим врстама воћа (у лимуновом соку 5–6%).
| |||
| Називи | |||
|---|---|---|---|
| IUPAC назив
Citrusna kiselina[1]
| |||
| Системски IUPAC назив
2-Хидроксипропан-1,2,3-трикарбоксилна киселина | |||
| Идентификација | |||
3Д модел (Jmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.000.973 | ||
| EC број | 201-069-1 | ||
| Е-бројеви | Е330 (антиоксиданси, ...) | ||
| КЕГГ[2] | |||
| RTECS | ГЕ7350000 | ||
| УНИИ | |||
| |||
| Својства | |||
| C6H8O7 | |||
| Моларна маса | 192,123 g/mol (anhidrat), 210,14 g/mol (monohidrat)[5] | ||
| Агрегатно стање | бела чврста материја | ||
| Мирис | без мириса | ||
| Густина | 1,665 g/cm3 (anhidrat) 1,542 g/cm3 (18 °C, monohidrat) | ||
| Тачка топљења | 156 °C (313 °F; 429 K) | ||
| Тачка кључања | 310 °C (590 °F; 583 K) razlaže se na 175 °C[6] | ||
| 54% w/w (10 °C) 59,2% w/w (20 °C) 64,3% w/w (30 °C) 68,6% w/w (40 °C) 70,9% w/w (50 °C) 73.5% w/w (60 °C) 76,2% w/w (70 °C) 78,8% w/w (80 °C) 81,4% w/w (90 °C) 84% w/w (100 °C)[7] | |||
| Растворљивост | Растворана у ацетону, алкохолу, етру, етил ацетату, ДМСО Нерастворана у C 6Х 6, ЦХЦл3, ЦС2, толуене[6] | ||
| Растворљивост у етанол | 62 g/100 g (25 °C)[6] | ||
| Растворљивост у амил ацетат | 4,41 g/100 g (25 °C)[6] | ||
| Растворљивост у диетил етар | 1,05 g/100 g (25 °C)[6] | ||
| Растворљивост у 1,4-Диоксан | 35,9 g/100 g (25 °C)[6] | ||
| log P | −1,64 | ||
| Киселост (пКа) | pKa1 = 3,13[8] pKa2 = 4,76[8] pKa3 = 6,39,[9] 6.40[10] | ||
| Индекс рефракције (nD) | 1.493–1.509 (20 °C)[7] 1,46 (150 °C)[6] | ||
| Вискозност | 6.5 cP (50% аq. сол.)[7] | ||
| Структура | |||
| Кристална решетка/структура | Моноклинична | ||
| Термохемија | |||
| Специфични топлотни капацитет, C | 226,51 J/(mol·K) (26,85 °C)[11] | ||
| Стандардна моларна ентропија S |
252,1 J/(mol·K)[11] | ||
Стд енталпија
формирања (ΔfH⦵298) |
−1543,8 kJ/mol[7] | ||
| 1985,3 kJ/mol (474,5 kcal/mol, 2,47 kcal/g),[7] 1960.6 кЈ/мол[11] 1972,34 kJ/mol (471,4 kcal/mol, 2,24 kcal/g) (монохидрат)[7] | |||
| Фармакологија | |||
| A09AB04 (WHO) | |||
| Opasnosti | |||
| Opasnost u toku rada | Iritant kože i očiju | ||
| Bezbednost prilikom rukovanja | HMDB | ||
| GHS grafikoni |  [8] [8]
| ||
| GHS signalna reč | Upozorenje | ||
| H319[8] | |||
| P305+351+338[8] | |||
| NFPA 704 | |||
| Tačka paljenja | 155 °C (311 °F; 428 K) | ||
| 345 °C (653 °F; 618 K) | |||
| Eksplozivni limiti | 8%[8] | ||
| Letalna doza ili koncentracija (LD, LC): | |||
LD50 (LD50)
|
3000 mg/kg (пацови, орално) | ||
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25 °C [77 °F], 100 kPa). | |||
| Референце инфокутије | |||
Бела је кристална супстанца киселог укуса, лако растворљива у води. Индустријски се добија из лимуна (у јужној Италији и Калифорнији) или из шећера ферментацијом помоћу плесни Aspergillus niger. Употребљава се у производњи безалкохолних напитака и у медицини. Њене соли су цитрати. Нормалан је састојак људске крви и урина (мокраће). Користи се у производњи шумећих таблета и витаминских напитака, воћних сокова, смрзнутог воћа итд... Узорци крви и ткива чувају се у растворима лимунске киселине.

Природни извори и индустријска производња
уредиЛимунске киселине има у разном воћу и поврћу, а највише у цитрусним плодовима. Лимун и лимете имају посебно високе концентрације киселине; може чинити чак 8% суве масе овог воћа (у соковима око 47 g/L[14]). То још увек не чини лимун посебно јако киселим. То је зато што, као слаба киселина, већина њених молекула није дисоцирана, те не доприноси киселости унутар лимуна или његовог сока. Концентрације лимунске киселине у лимунским плодовима крећу се од 0,005 mol/L за наранџе и грејпфрут до 0,30 mol/L у лимуну и лимети; ове вредности варирају унутар врста, зависно од сорте и околностима у којима је воће узгајано.
Производња лимунске киселине у индустријским размерама први је пут започела 1890. Године, у италијанској индустрији цитрусних плодова, где је сок третиран хидратизираним кречом (калцијум хидроксид) да се исталожи калцијум цитрат, који је изолован и преведен назад у киселину помоћу разблажене сумпорне киселине.[15] Године 1893, Карл Вемер открио је да гљивице, плесни рода Penicillium могу произвести лимунску киселину из шећера. Међутим, микробна производња лимунске киселине није постала индустријски важна све док Први светски рат није пореметио италијански извоз лимуна.
Након што се плесан филтрира из резултујућег раствора, лимунска киселина се изолира помоћу таложења калцијум хидроксидом, дајући калцијумову цитратну со, из које се лимунска киселина обнавља третирањем сумпорном киселином, као у директној екстракцији сока цитрусних плодова.
Предузећу Левер Бродерс је 1977. године одобрен патент за хемијску синтезу лимунске киселине, полазећи од аконитне или изоцитратне / алоизоцитратне соли калцијума, под условима високог притиска; ово је створило лимунску киселину у близу квантитативној конверзији онога што се чинило обрнутим, неензимским реакцијама Кребсовог циклуса.[16]
Године 2018, глобална производња лимунске киселине достигла је 2,000.000 тона.[17] Више од 50% овог обима произведено је у Кини. Више од 50% кориштено је као регулатор киселости у пићима, око 20% у другим намирницама, а 20% у детерџентима и 10% у апликацијама које нису храна, попут козметике, фармацеутских производа и хемијске индустрије.
Хемијска обележја
уредиЛимунску киселину је први пут изоловао Карл Вилхелм Шеле 1784. године, хемичар који ју је кристализовао из лимуновог сока.[15][18][19]
Лимунска киселина може постојати или у безводном (анхидридном) облику или као монохидрат. Безводни облик се кристализује из вруће воде, док монохидрат настаје када се лимунска киселина кристализује из хладне воде. Монохидрат се може претворити у безводни облик на око 78 °C. Лимунска киселина се такође раствара у апсолутном (безводном) етанолу (76 делова лимунске киселине на 100 делова етанола) на 15 °C. Разграђује се губитком угљен диоксида, изнад око 175 °C.
Лимунска киселина се обично сматра троосновном киселином, са pKa, екстраполираном на нулту ионску снагу, од 2,92, 4,28 и 5,21 на 25 °C.[20] Константа pKa хидроксил групе нађена је спектроскопски (13C НМР), а износи просечно 14,4.[21]
Специјацијски дијаграм показује да су раствори лимунске киселине пуферски раствори , са и pH између око 2 и pH 8. У биолошким системима pH је око 7, у обе присутне врсте: цитратни и моноводоник-цитратни јон.[22][23] Доступне су и компилиране табеле за студиј биохемије[24]
Цитратни јон формира комплексе са металним катјонима. Константе стабилности за стварање ових комплекса прилично су велике због хелатног ефекта. Он ствара комплексе чак и са катјонима алкалних метала. Међутим, када се хелатни комплекс формира помоћу све три карбоксилатне групе, хелатни прстенови имају 7 и 8 чланова, који су генерално термодинамички мање стабилни од мањих хелатних прстенова. Као последица тога, хидроксилна група може се депротоновати, чинећи део стабилнијег петочланог прстена, као у амонијум-жељезном цитрату, (НХ
4)
5Фе(C
6Х
4О
7)
2·2Х
2О.[25]
Циклус лимунске киселине
уредиЦитрат је међупродукат у ТЦА-циклусу (Три C (од carboxyl) А (од acid = киселина) или Кребсов циклус, а по Сент Ђерђију, централни метаболички пут за животиње, биљке и бактерије. Цитрат-синтаза катализује кондензацију оксалоацетата са ацетил-КоА дајући цитрат. Цитрат тада делује као супстрат за аконитазу и претвара се у аконитну киселину. Циклус се завршава регенерацијом оксалоацетата. Ова серија хемијских реакција, код виших организама, извор је две трећине енергије добијене храном. За ово откриће, Ханс Адолф Кребс добио је 1953. Нобелову награду за физиологију или медицину.
Неке бактерије (посебно E. coli) могу произвести и конзумирати цитрат изнутра као део свог ТЦА циклуса, али га не могу користити као храну, јер им недостају ензими потребни за унос у ћелију. Након десетина хиљада еволуција у минималном медију глукозе који је такође садржавао цитрат током дугорочног еволуцијског експеримента, који је извео Ричард Ленски на E. coli еволуирао је способношћу аеробног раста на цитрату. Захари Блант, студент Ленског и његове колеге проучавали су ове „Cit+” E. coli,[26][27] као модел за развој нових особина. Пронашли су доказе да је, у овом случају, иновација узрокована ретком мутацијом дуплирања услед накупљања неколико претходних „потенцирајућих” мутација, чији су идентитет и учинци још увек у фази проучавања. Еволуција обележја Cit+ сматрана је значајним примером улоге историјског контингента у еволуцији.
Остале биолошке улоге
уредиЦитрат се може транспортовати из митохондрија у цитоплазму, затим разградити на ацетил-КоА за синтезу масних киселина и у оксалоацетат. Цитрат је позитивни модулатор ове конверзије и алостерно регулише ензим ацетил-КоА карбоксилаза, који је регулаторни ензим у конверзији ацетил-КоА у малонил-КоА (корак улагања у синтезу масне киселине). Укратко, цитрат се транспортује у цитоплазму, претвара у ацетил КоА, који се затим претвара у малонил КоА помоћу ацетил КоА карбоксилазе, коју цитрат алостерно модулише.
Високе концентрације цитосолног цитрата могу инхибирати фосфофруктокиназу, катализатор корака који ограничава брзину гликолизе. Овај је учинак повољан: високе концентрације цитрата указују на то да постоји велика количина молекула биосинтетских прекурсора, па нема потребе да фосфофруктокиназа и даље шаље молекуле свог супстрата, фруктоза 6-фосфата у гликолизу. Цитрат делује појачавајући инхибиторни учинак високих концентрација АТП, још један знак да нема потребе за провођењем гликолизе.[28]
Референце
уреди- ^ ЦхемСпидер листс 'цитриц ацид' ас тхе еxперт-верифиед ИУПАЦ наме.
- ^ Јоанне Wиxон; Доуглас Келл (2000). „Wебсите Ревиеw: Тхе Кyото Енцyцлопедиа оф Генес анд Геномес — КЕГГ”. Yеаст. 17 (1): 48—55. дои:10.1002/(СИЦИ)1097-0061(200004)17:1<48::АИД-YЕА2>3.0.ЦО;2-Х.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ PubChem CID 22230
- ^ а б в г д ђ е „citric acid”. chemister.ru. Архивирано из оригинала 29. 11. 2014. г. Приступљено 1. 6. 2014.
- ^ а б в г д ђ PubChem CID 311
- ^ а б в г д ђ Fisher Scientific, Citric acid. Retrieved on 2014-06-02.
- ^ „Data for Biochemical Research”. ZirChrom Separations, Inc. Приступљено 11. 1. 2012.
- ^ „Ionization Constants of Organic Acids”. Michigan State University. Приступљено 11. 1. 2012.
- ^ а б в Citric acid in Linstrom, P.J.; Mallard, W.G. (eds.) NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD. http://webbook.nist.gov (retrieved 2014-06-02)
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ Thomas L. Lemke; David A. Williams, ур. (2007). Foye's Principles of Medicinal Chemistry (6. изд.). Baltimore: Lippincott Willams & Wilkins. ISBN 0781768799.
- ^ Penniston KL, Nakada SY, Holmes RP, Assimos DG (2008). „Quantitative Assessment of Citric Acid in Lemon Juice, Lime Juice, and Commercially-Available Fruit Juice Products”. Journal of Endourology. 22 (3): 567—570. PMC 2637791 . PMID 18290732. doi:10.1089/end.2007.0304.
- ^ а б Frank H. Verhoff (2005). „Citric Acid”. Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH.
- ^ US 4056567-V.Lamberti and E.Gutierrez
- ^ „Global Citric Acid Markets Report, 2011-2018 & 2019-2024”. prnewswire.com. 19. 3. 2019. Приступљено 28. 10. 2019.
- ^ Scheele, Carl Wilhelm (1784). „Anmärkning om Citron-saft, samt sätt at crystallisera densamma” [Note about lemon juice, as well as ways to crystallize it]. Kungliga Vetenskaps Academiens Nya Handlingar [New Proceedings of the Royal Academy of Science]. 2nd series. 5: 105—109.
- ^ Graham, Thomas (1842). Elements of chemistry, including the applications of the science in the arts. Hippolyte Baillière, foreign bookseller to the Royal College of Surgeons, and to the Royal Society, 219, Regent Street. стр. 944. Приступљено 4. 6. 2010.
- ^ Goldberg, Robert N.; Kishore, Nand; Lennen, Rebecca M. (2002). „Thermodynamic Quantities for the Ionization Reactions of Buffers”. J. Phys. Chem. Ref. Data. 31 (1): 231—370. Bibcode:2002JPCRD..31..231G. doi:10.1063/1.1416902.
- ^ Silva, Andre M. N.; Kong, Xiaole; Hider, Robert C. (2009). „Determination of the pKa value of the hydroxyl group in the α-hydroxycarboxylates citrate, malate and lactate by 13C NMR: implications for metal coordination in biological systems”. Biometals. 22 (5): 771—778. PMID 19288211. doi:10.1007/s10534-009-9224-5.
- ^ SSC 20X hybridization buffer je primer uobičajene upotrebe.
- ^ Maniatis, T.; Fritsch, E. F.; Sambrook, J. 1982. Molecular Cloning: A Laboratory Manual. Cold Spring Harbor Laboratory, Cold Spring Harbor, NY.
- ^ Gomori, G. (1955). „16 Preparation of buffers for use in enzyme studies”. Methods in Enzymology Volume 1. Methods in Enzymology. 1. стр. 138–146. ISBN 9780121818012. doi:10.1016/0076-6879(55)01020-3.
- ^ Matzapetakis, M.; Raptopoulou, C. P.; Tsohos, A.; Papaefthymiou, V.; Moon, S. N.; Salifoglou, A. (1998). „Synthesis, Spectroscopic and Structural Characterization of the First Mononuclear, Water Soluble Iron−Citrate Complex, (NH4)5Fe(C6H4O7)2·2H2O”. J. Am. Chem. Soc. 120 (50): 13266—13267. doi:10.1021/ja9807035.
- ^ Powell, Alvin (14. 2. 2014). „59,000 generations of bacteria, plus freezer, yield startling results”. phys.org. Приступљено 13. 4. 2017.
- ^ Blount, Z. D.; Borland, C. Z.; Lenski, R. E. (4. 6. 2008). „Historical contingency and the evolution of a key innovation in an experimental population of Escherichia coli” (PDF). Proceedings of the National Academy of Sciences. 105 (23): 7899—7906. Bibcode:2008PNAS..105.7899B. PMC 2430337 . PMID 18524956. doi:10.1073/pnas.0803151105. Архивирано из оригинала (PDF) 21. 10. 2016. г. Приступљено 13. 4. 2017.
- ^ Stryer, Lubert; Berg, Jeremy; Tymoczko, John (2003). „Section 16.2: The Glycolytic Pathway Is Tightly Controlled”. Biochemistry (5. ed., international ed., 3. printing изд.). New York: Freeman. ISBN 978-0716746843.
Spoljašnje veze
уреди- British Pharmacopoeia Commission Secretariat (2009). „Index, BP 2009” (PDF). Архивирано из оригинала (PDF) 11. 4. 2009. г. Приступљено 4. 2. 2010.
- „Japanese Pharmacopoeia, Fifteenth Edition” (PDF). 2006. Архивирано из оригинала (PDF) 22. 7. 2011. г. Приступљено 4. 2. 2010.