Изотоп
Изотопи су атоми хемијског елемента чије језгро има исти атомски број, Z, али различиту атомску масу, A. Реч изотоп, значи на истом месту, и долази од чињенице да се изотопи налазе на истом месту у периодном систему елемената. Изотопни однос је стални однос изотопа у хемијским елементима у природи, и карактеристична величина за сваку атомску врсту.[1]
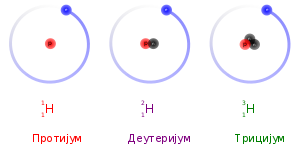
Атомски број одговара броју протона у атому, Стога изотопи датог елемента садрже једнак број протона. Разлика у атомским масама потиче из разлике у броју неутрона у атомском језгру. У научној номенклатури, изотопи се означавају именима датог елемента иза ког следи цртица, па број нуклеона (протона и неутрона) у атомском језгру (нпр., хелијум-3, угљеник-12, угљеник-14, гвожђе-57, уранијум-238). У симболичкој форми, број нуклеона се исказује изнад хемијског симбола са леве стране (нпр., 3He, 12C, 14C, 57Fe, 238U).[2]
Изотопи свих елемента образују скуп нуклида. Нуклид је дефиниција за одређено атомско језгро и дефинише се редним бројем Z и масеним бројем A: AZХх (32He, 23892U) Строго говорећи, пре би требало рећи да се елемент као на пример флуор састоји од једног нуклида него од једног изотопа.[3]
У неутралном атому, број електрона је једнак броју протона. Стога, изотопи датог елемента такође имају и исти број електрона и исту електронску структуру. Како је хемијско понашање атома у највећој мери одређено његовом електронском структуром, изотопи имају скоро идентичне хемијске особине. Главни изузетак је, да, услед већих маса, тежи изотопи имају тенденцију да реагују нешто спорије од лакших изотопа. Овај „ефекат масе“, или изотопски ефекат је најизраженији за протијум (1H) и деутеријум (уобичајен назив за 2H), јер деутеријум има дупло већу масу од протијума. Код тежих елемената је релативна разлика у маси много мања, па је ефекат масе обично занемарљив.
Мада, изотопи имају скоро идентичне електронске и хемијске особине, њихове нуклеарне особине се драматично разликују. Атомско језгро се састоји из протона и неутрона које на окупу држи јака нуклеарна сила. Како су протони позитивно наелектрисани, они се међусобно одбијају. Неутрони који су електронеутрални праве одређену дистанцу између протона, редукују електростатичко одбијање и стабилизују језгро. Из овог разлога су потребни неутрони да би се два или више протона везали у језгро. Како број протона расте, потребни су додатни неутрони да би се формирало стабилно језгро, на пример, иако је однос неутрон/протон код 3He 1/2, неутрон/протон однос код 238U је >3/2. Ипак, ако је присутно превише неутрона, језгро постаје нестабилно.
Како изотопи датог елемента имају различит број неутрона, они имају и различит однос неутрон/протон. Ово утиче на њихову нуклеарну стабилност, што резултује чињеницом да неки изотопи подлежу нуклеарном распаду. Распад ових радиоактивних изотопа (краће радиоизотопа) је важна тема у нуклеарној физици. Проучавањем начина на који се овај распад одиграва, физичари стичу увид у својства атомског језгра.
Обично се у природи може наћи неколико изотопа истог елемента. Најчешће се јављају стабилни изотопи, мада се могу наћи и значајне количине нестабилних изотопа са великим временом полураспада као на пример уранијум-238. Мале количине радиоактивних изотопа са малим временом полураспада су такође присутне у природи. Ови изотопи настају као производ распада већих радиоактивних језгара са дужим животом. Атомска маса елемента у периодном систему елемената је просек природне распрострањености изотопа тог елемента.
Природна распрострањеност разних изотопа на Земљи је у крајњој линији резултат количина изотопа формираних у звездама и суперновама, као и шема распада радиоактивних језгара формираних у овим процесима. Затим, формирање Сунчевог система је такође значајно утицало на пропорције различитих изотопа који се могу наћи на Земљи, јер су соларни ветрови одмах по стварању Сунца лакше могли да одувају лакша језгра ка даљим деловима сунчевог система. Због овога се велике гасовите планете налазе даље од Сунца.
Изотоп наспрам нуклида
уредиНуклид је врста атома са специфичним бројем протона и неутрона у језгру, на пример угљеник-13 са 6 протона и 7 неутрона. Концепт нуклида (који се односи на појединачне нуклеарне врсте) наглашава нуклеарна својства у односу на хемијска, док концепт изотопа (груписање свих атома сваког елемента) наглашава хемијска над нуклеарним. Неутронски број у великој мери утиче на нуклеарна својства, али је његов утицај на хемијска својства занемарљив за већину елемената. Чак и за најлакше елементе, чији однос броја неутрона и атомског броја највише варира између изотопа, обично има само мали ефекат иако је у неким околностима битан (за водоник, најлакши елемент, ефекат изотопа је довољно велик да снажно утиче на биологију). Термин изотопи (првобитно такође изотопски елементи,[4] сада понекад изотопски нуклиди[5]) треба да имплицира поређење (попут синонима или изомера). На пример, нуклиди 126C, 136C, 146C су изотопи (нуклиди са истим атомским бројем, али различитим масеним бројем[6]), али 4018Ar, 4019K, 4020Ca су изобаре (нуклиди са истим масеним бројем[6]). Међутим, изотоп је старији термин и зато је познатији од нуклида и још увек се понекад користи у контекстима у којима би нуклид могао бити прикладнији, као што су нуклеарна технологија и нуклеарна медицина.
Нотација
уредиИзотоп и/или нуклид су специфицирани именом одређеног елемента (ово означава атомски број), праћеним цртицом и масеним бројем (нпр. хелијум-3, хелијум-4, угљеник-12, угљеник-14, уранијум- 235 и уранијум-239).[7] Када се користи хемијски симбол, нпр. „C” за угљеник, стандардна нотација (сада позната као „ AZEнотација” јер је A масени број, Z атомски број, а E за елемент) означава масени број (број нуклеона) са суперскриптом на врху лево од хемијског симбола и за означавање атомског броја са субскриптом у доњем левом углу (нпр. 32He, 42He, 126C, 146C, 23592U, и 23992U).[8] Пошто је атомски број дат симболом елемента, уобичајено је навести само масени број у суперскрипту, а изоставити субскрипт атомског броја (нпр. 3He, 4He, 12C, 14C, 235U, и 239U). Слово m (за метастабилно) се понекад додаје иза масеног броја да би се означио нуклеарни изомер, метастабилно или енергетски побуђено нуклеарно стање (за разлику од основног стања најниже енергије), на пример 180m73Ta (тантал-180м).
Уобичајени изговор AZE нотације се разликује од начина на који је написано: 42He се обично изговара као хелијум-четири уместо четири-два-хелијум, а 23592U као уранијум два-тридесет-пет (амерички енглески) или уранијум-два-три-пет (британски) уместо 235-92-ураниј.
Радиоактивни, примордијални и стабилни изотопи
уредиНеки изотопи/нуклиди су радиоактивни и стога се називају радиоизотопи или радионуклиди, док за друге никада није примећено да се радиоактивно распадају и називају се стабилним изотопима или стабилним нуклидима. На пример, 14C је радиоактивни облик угљеника, док су 12C и 13C стабилни изотопи. На Земљи постоји око 339 природних нуклида, од којих су 286 примордијални нуклиди, што значи да постоје од формирања Сунчевог система.[9][10][11][12]
Примордијални нуклиди обухватају 35 нуклида са веома дугим полуживотом (преко 100 милиона година) и 251 који се формално сматрају „стабилним нуклидима“,[13] јер није примећено да се распадају. У већини случајева, из очигледних разлога, ако елемент има стабилне изотопе, ти изотопи преовлађују у обиљу елемената који се налази на Земљи и у Сунчевом систему. Међутим, у случајевима три елемента (телур, индијум и ренијум) најзаступљенији изотоп који се налази у природи је заправо један (или два) изузетно дуговечна радиоизотопа елемента, упркос томе што ови елементи имају један или више стабилних изотопа.
Теорија предвиђа да су многи наизглед „стабилни“ нуклиди радиоактивни, са изузетно дугим полураспадом (немајући могућност протонског распада,[14][15][16][17][18] што би све нуклиде на крају учинило нестабилним). Неки стабилни нуклиди су у теорији енергетски подложни другим познатим облицима распадања, као што су алфа распад или двоструки бета распад, али још увек нису примећени производи распада, те се каже да су ови изотопи „опсервационо стабилни“. Предвиђени периоди полураспада за ове нуклиде често знатно премашују процењену старост универзума, и заправо постоји и 31 познати радионуклид (види примордијални нуклид) са периодом полураспада дужим од старости универзума.
Ако се додају радиоактивни нуклиди који су вештачки створени, тренутно је познато 3.339 нуклида.[19] Ово укључује 905 нуклида који су или стабилни или имају полуживот дужи од 60 минута. За детаље погледајте листу нуклида.[20][21][22][23][24][25][26]
Стабилни изотопи
уредиВећина хемијских елемената у природи смесе су природних изотопа, који су било стабилни било радиоактивни (нестабилни). Стабилне изотопе има 81 хемијски елемент. То су редом сви елементи, од водоника (Z = 1) до укључиво бизмута (Z = 83), уз изузетак технецијума (Z = 43) и прометијума (Z = 61). Многи елементи имају више стабилних изотопа, а то је разлог што њихове релативне атомске масе нису цели бројеви. Водоник је, на пример, смеша стабилних изотопа 1H и 2H, угљеник садржи стабилне изотопе 12C и 13C, кисеоник изотопе 16O, 17O и 18O и тако даље. Највише стабилних изотопа, њих 10, има калај. Укупно се у природи налази око 270 врста стабилних и око 70 врста радиоактивних нуклида.
Радиоактивни изотопи, радиоизотопи (радионуклиди) појединих елемената, пореклом су природни или вештачки. Природне радиоизотопе имају многи елементи који садрже и стабилне изотопе, а такође и сви природни радиоактивни елементи, то јест они који не садрже стабилне изотопе. То су елементи од полонијума до укључиво плутонијума (Z = 84 до 94) те елемент прометијум. Нуклеарним реакцијама могу се произвести вештачки радиоизотопи готово свих елемената, па је данас познато око 2 500 врста нуклида, што природних, што вештачких. Сви се они могу сврстати у карту нуклида, у којој је сваки нуклид приказан квадратом с различитим, за њега карактеристичним подацима (изотопна обилност, време полураспада, врста и енергија зрачења и тако даље). Изотопи појединих елемената сврстани су у водоравним редовима према растућој маси.
Нестабилни изотопи
уредиНестабилни изотопи, односно радиоактивни изотопи или радионуклиди су атоми који имаму однос протона и неутрона већи или мањи од односа потребног за стабилност. Нестабилни изотопи теже стабилности, а то се постиже радиоактивним распадом (радиоактивност). Последице радиоактивног распада је мењање масе и/или хемијских својстава радионуклида уз истодобно емитирање јонизујућег зрачења. Сви елементи изнад редног броја 82 (олово) су нестабилни јер одбојним силама протона више нису довољни неутрони као равнотежа. Наиме, превелика је концентрација протона на једном месту.
Језгра радионуклида се спонтано распада прелазећи при томе у неко друго језгро. Приликом распада језгро радионуклида емитује честице и/или електромагнетне зраке кратке таласне дужине. Емитоване честице и електромагнетски зраци се једним именом зову јонизујуће зрачење. То је појава радиоактивности, а сам процес је трансмутација, тј. спонтани прелаз једног језгра у друго, што се назива радиоактивни распад.
Нуклид је атом хемијског елемента за који је тачно познат не само редни или атомски број Z, већ и укупан број нуклеона (протона и неутрона) у атомском језгру. У природи постоје само 92 хемијска елемента и још 12 вештачки произведених, а познато је око 3 100 различитих нуклида, од којих је 350 природних и 2 750 вештачких. Већина нуклида је нестабилна (радиоактивна), око 2800. Погодна комбинација протона и неутрона чини атомско језгру стабилном, чим је другачије језгро настоји да се избацивањем нуклеона приближи стабилној конфигурацији. Енергијски нивои у језгру се попуњавају како би се достигла конфигурације минималне енергије, то јест максималне стабилности.
Историја
уредиРадиоактивни изотопи
уредиПостојање изотопа је први пут сугерисао радиохемичар Фредерик Соди 1913. године на основу студија ланаца радиоактивног распада које су указале на око 40 различитих врста које се називају радиоелементи (тј. радиоактивни елементи) између уранијума и олова, иако је периодична табела дозвољавала само 11 елементи између олова и уранијума.[27][28][29]
Неколико покушаја да се ови нови радиоелементи хемијски одвоје су пропали.[30] На пример, Соди је 1910. показао да је мезоторијум (касније се показало да је 228Ra), радијум (226Ra, најдуговечнији изотоп) и торијум X (224Ra) немогуће раздвојити.[31] Покушаји да се радиоелементи сместе у периодни систем навели су Содија и Казимиерза Фајанса да независно предложе свој закон радиоактивног померања 1913. године, према коме алфа распад производи елемент два места лево у периодном систему, док емисија бета распада производи елемент једно место удесно.[32][33][34][35] Соди је препознао да је емисија алфа честице праћене са две бета честице довела до формирања елемента хемијски идентичног почетном елементу, али са масом за четири јединице лакшом и са различитим радиоактивним својствима.
Соди је предложио да неколико типова атома (који се разликују по радиоактивним својствима) може да заузме исто место у табели.[29] На пример, алфа распад уранијума-235 формира торијум-231, док бета распад актинијума-230 формира торијум-230.[30] Термин „изотоп“, грчки за „на истом месту“,[29] је Содију предложила Маргарет Тод, шкотска лекарка и породична пријатељица, током разговора у којем јој је објаснио своје идеје.[31][36][37][38][39][40] Он је добио Нобелову награду за хемију 1921. делом за свој рад на изотопима.
Године 1914, Т. В. Ричардс је пронашао варијације између атомске тежине олова из различитих минералних извора, које се могу приписати варијацијама у изотопском саставу због различитог радиоактивног порекла.[30][41][42]
Стабилни изотопи
уредиПрви доказ за више изотопа стабилног (нерадиоактивног) елемента пронашао је Џозеф Џон Томсон 1912. године као део свог истраживања састава каналних зрака (позитивних јона).[43] Томсон је каналисао токове неонских јона кроз паралелна магнетна и електрична поља, мерио њихов отклон постављањем фотографске плоче на њихову путању и израчунавао њихов однос масе и наелектрисања користећи метод који је постао познат као Томсонова параболна метода. Сваки млаз је створио блиставу мрљу на плочи на тачки у коју је ударио. Томсон је приметио две одвојене параболичне мрље светлости на фотографској плочи (погледајте слику), што је сугерисало две врсте језгара са различитим односом масе и наелектрисања. Он је написао: „Стога, мислим да нема сумње да оно што се назива неон није једноставан гас, већ мешавина два гаса, од којих један има атомску тежину око 20, а други око 22. Парабола тежег гаса је увек много слабија од оног због лакшег, тако да вероватно тежи гас чини само мали проценат смеше.“[44]
Ф.В. Астон је касније открио више стабилних изотопа за бројне елементе користећи масени спектрограф. Године 1919, Астон је проучавао неон са довољном резолуцијом да покаже да су две изотопске масе веома блиске целим бројевима 20 и 22 и да ниједна није једнака познатој моларној маси (20,2) гаса неона. Ово је пример Астоновог правила целог броја за изотопске масе, које каже да су велика одступања елементарних моларних маса од целих бројева првенствено последица чињенице да је елемент мешавина изотопа. Астон је на сличан начин показао 1920. године да је моларна маса хлора (35,45) пондерисани просек скоро интегралних маса за два изотопа 35Cl и 37Cl.[45][46]
Неутрони
уредиНакон открића неутрона од стране Џејмса Чедвика 1932. године,[47] разјашњен је ултиматни основни узрок постојања изотопа, то јест, језгра различитих изотопа за дати елемент имају различит број неутрона, иако имају исти број од протона.
Варијације у својствима између изотопа
уредиХемијска и молекуларна својства
уредиНеутрални атом има исти број електрона као и протони. Дакле, сви различити изотопи датог елемента имају исти број електрона и деле сличну електронску структуру. Пошто је хемијско понашање атома у великој мери одређено његовом електронском структуром, различити изотопи показују скоро идентично хемијско понашање.
Главни изузетак од овога је кинетички изотопски ефекат:[48][49][50] због своје веће масе, тежи изотопи имају тенденцију да реагују нешто спорије од лакших изотопа истог елемента. Ово је далеко најизраженије за протијум (1H), деутеријум (2H) и трицијум (3H), јер деутеријум има двоструко већу масу од протијума, а трицијум има три пута већу масу од протијума.[51] Ове разлике у маси такође утичу на понашање њихових одговарајућих хемијских веза, променом центра гравитације (редуковане масе) атомских система. Међутим, за теже елементе, релативна разлика у маси између изотопа је много мања, тако да су ефекти масене разлике на хемију обично занемарљиви. (Тешки елементи такође имају релативно више неутрона него лакши елементи, тако да је однос нуклеарне масе и колективне електронске масе нешто већи.) Постоји и ефекат равнотеже изотопа.[52]
Слично томе, два молекула која се разликују само по изотопима својих атома (изотополози[53][54]) имају идентичну електронску структуру, и стога готово неразлучива физичка и хемијска својства (опет са деутеријумом и трицијумом који су примарни изузеци). Вибрациони модови молекула су одређени његовим обликом и масама његових конститутивних атома; тако да различити изотополози имају различите скупове вибрационих модова. Пошто вибрациони модови дозвољавају молекулу да апсорбује фотоне одговарајућих енергија, изотополози имају различита оптичка својства у инфрацрвеном опсегу.
Нуклеарна својства и стабилност
уредиАтомска језгра се састоје од протона и неутрона повезаних резидуалном јаком силом. Пошто су протони позитивно наелектрисани, одбијају се једни од других. Неутрони, који су електрично неутрални, стабилизују језгро на два начина. Њихово присуство мало размиче протоне, смањујући електростатичко одбијање између протона, и они врше привлачну нуклеарну силу једни на друге и на протоне. Из тог разлога, један или више неутрона су неопходни да би се два или више протона везали у језгро. Како се број протона повећава, тако се повећава и однос неутрона и протона неопходан да би се обезбедило стабилно језгро (погледајте графикон десно). На пример, иако је однос неутрон:протон код 32He 1:2, однос неутрон:протон код 23892U је већи од 3:2. Један број лакших елемената има стабилне нуклиде у односу 1:1 (Z = N). Нуклид 4020Ca (калцијум-40) је опсервационо најтежи стабилни нуклид са истим бројем неутрона и протона. Сви стабилни нуклиди тежи од калцијума-40 садрже више неутрона него протона.
Број изотопа по елементу
уредиОд 80 елемената са стабилним изотопом, највећи број стабилних изотопа уочених за било који елемент је десет (за елемент калај). Ниједан елемент нема девет или осам стабилних изотопа. Пет елемената има седам стабилних изотопа, осам има шест стабилних изотопа, десет има пет стабилних изотопа, девет има четири стабилна изотопа, пет има три стабилна изотопа, 16 има два стабилна изотопа (рачунајући 180m73Ta као стабилног), а 26 елемената има само један стабилни изотоп (међу њима 19 су тзв. мононуклидни елементи, који имају један примордијални стабилни изотоп који доминира и фиксира атомску тежину природног елемента до високе прецизности; јављају се и 3 радиоактивна мононуклидна елемента).[55] Укупно постоји 251 нуклид за који није примећено да се распада. За 80 елемената који имају један или више стабилних изотопа, просечан број стабилних изотопа је 251/80 ≈ 3,14 изотопа по елементу.
Парни и непарни бројеви нуклеона
уреди| p, n | EE | OO | EO | OE | Укупно |
|---|---|---|---|---|---|
| Стабилни | 145 | 5 | 53 | 48 | 251 |
| Дуговечни | 23 | 4 | 3 | 5 | 35 |
| Сва примордијални | 168 | 9 | 56 | 53 | 286 |
Однос протон:неутрон није једини фактор који утиче на нуклеарну стабилност. Она такође зависи од парности или непарности његовог атомског броја Z, неутронског броја N и, последично, њиховог збира, масеног броја A. Непарност и Z и N има тенденцију смањивања нуклеарне енергије везивања, чинећи непарна језгра, генерално, мање стабилним. Ова изузетна разлика у енергији нуклеарног везивања између суседних језгара, посебно непарних A изобара, има важне последице: нестабилни изотопи са неоптималним бројем неутрона или протона распадају се бета распадом (укључујући емисију позитрона), хватањем електрона или другим мање уобичајеним распадом модовима као што су спонтана фисија[56][57] и распад кластера.[58][59]
Већина стабилних нуклида су облика парни-протон-парни-неутрон, где су сви бројеви Z, N, и A парни. Нуклиди са непарним A су подељени (приближно равномерно) на неутроне облика непарни-протон-парни-неутрон и парни-протон-непарни-неутрон. Стабилни непарни-протон-непарни-неутрон нуклиди су најмање заступљени.
Парни атомски број
уредиСед од 146 нуклида облика парни-протон, парни-неутрона (ЕЕ) чини ~58% свих стабилних нуклида и сви имају спин 0 због упаривања. Постоје и 24 примордијална дуговечна парно-парна нуклида. Као резултат, сваки од 41 парна елемента од 2 до 82 има најмање један стабилан изотоп, и већина ових елемената има неколико примордијалних изотопа. Половина ових парних елемената има шест или више стабилних изотопа. Екстремна стабилност хелијума-4 је последица двоструког упаривања[60][61] 2 протона и 2 неутрона што спречава да било који нуклид који садржи пет (52He, 53Li) или осам (84Be) нуклеона постоји довољно дуго да служе као платформе за накупљање тежих елемената путем нуклеарне фузије у звездама (погледајте троструки алфа процес).
| Распад | Полуживот | |
|---|---|---|
| 11348Cd | бета | 7,7×1015 a |
| 14762Sm | алфа | 1,06×1011 a |
| 23592U | алфа | 7,04×108 a |
Само пет стабилних нуклида садржи непаран број протона и непаран број неутрона. Прва четири „непарно-непарна” нуклида се јављају у нуклидима мале масе, за које би промена протона у неутрон или обрнуто довела до веома једностраног односа протон-неутрон (21H, 63Li, 105B, и 147N; спинови 1, 1, 3, 1). Сматра се да је једини други потпуно „стабилан“ непар-непарни нуклид, 180m73Ta (спин 9), најређи од 251 стабилног нуклида, и једини је примордијално нуклеарни изомер, за који још увек није примећено да се распада упркос експерименталним покушајима.[62]
Познати су многи непарни-непарни радионуклиди (као што је основно стање тантала-180) са релативно кратким полуживотом. Обично се бета распадају до својих оближњих парно-парних изобара који имају упарене протоне и упарене неутроне. Од девет примордијалних нуклида облика непаран-непаран (пет стабилних и четири радиоактивна са дугим периодом полураспада), само је 147N најчешћи изотоп широко заступљеног елемента. Ово је случај јер је део CNO циклуса. Нуклиди 63Li и 105B су мањински изотопи елемената који су и сами ретки у поређењу са другим лаким елементима, док осталих шест изотопа чине само мали удео природне заступљености њихових елемената.
Непарни атомски број
уредиСет од 53 стабилна нуклида имају паран број протона и непаран број неутрона. Они су мањина у поређењу са парно-парним изотопима, којих је око 3 пута више. Међу 41 елемента са парним Z који имају стабилан нуклид, само два елемента (аргон и церијум) немају парно-непарне стабилне нуклиде. Један елемент (калај) има три. Постоје 24 елемента који имају један паран-непарни нуклид и 13 који имају два непарно-парна нуклида. Од 35 примордијалних радионуклида постоје четири парно-непарна нуклида (погледајте табелу десно), укључујући фисијски 23592U. Због свог непарног броја неутрона, парно-непарни нуклиди имају тенденцију да имају велике попречне пресеке хватања неутрона, због енергије која је резултат ефеката упаривања неутрона. Ови стабилни нуклиди парних протона непарних неутрона су неуобичајени у погледу заступљености у природи, генерално зато што да би се формирали и ушли у примордијалну заступљеност, морали би да избегну хватања неутрона чиме би формирали још неке стабилне парно-парне изотопе, током оба s-процеса и r-процеса хватања неутрона, током нуклеосинтезе у звездама. Из тог разлога, само су 19578Pt и 94Be природно најзаступљенији изотопи свог елемента.
Сет од 48 стабилних нуклида облика непарни-протон-парни-неутрон, стабилизованих њиховим упареним неутронима, формира већину стабилних изотопа непарних елемената; врло мало нуклида облика непарни-протон-непарни-неутрон чине остале. Постоји 41 непарни елемент са Z = 1 до 81, од којих 39 има стабилне изотопе (технецијум (Tc) и прометијум (Pm) немају стабилне изотопе). Од ових 39 елемената са непарним Z, 30 елемената (укључујући водоник-1 где је 0 неутрона парано) има један стабилан непарно-парни изотоп и девет елемената: хлор (Cl), калијум (K), бакар (Cu), галијум (Ga), бром (Br), [[silver]|сребро]] (Ag), антимон (Sb), иридијум (Ir), and талијум (Tl), имају по два непарно-парна стабилна изотопа. Ово чини укупно 30 + 2(9) = 48 стабилних непарно-парних изотопа.
Такође постоји пет примордијалних дуговечних радиоактивних непарно-парних изотопа, 8737Rb, 11549In, 18775Re, 15163Eu, и 20983Bi. Последња два су тек недавно откривена да се распадају, са периодом полураспада дужим од 1018 година.
Непарни неутронски број
уреди| N | Паран | Непаран |
|---|---|---|
| Стабилан | 193 | 58 |
| Дуговечан | 28 | 7 |
| Сви примордијални | 221 | 65 |
Актиниди са непарним бројем неутрона су генерално фисиони (са термичким неутронима[63][64][65]), док они са парним бројем неутрона генерално нису, иако подлежу фисији са брзим неутронима. Сви опсервациони стабилни нуклиди облика непаран-непаран имају целобројни спин различит од нуле. То је зато што појединачни неупарени неутрон и неупарени протон имају већу привлачност нуклеарне силе једни према другима, ако су њихови спинови поравнати (стварајући укупан спин од најмање 1 јединице), уместо антипоравнаних. Погледајте деутеријум за најједноставнији случај овог нуклеарног понашања.
Само 19578Pt, 94Be, и 147N имају непаран број неутрона и најприроднији су изотоп свог елемента.
Појава у природи
уредиЕлементи се састоје било од једног нуклида (мононуклидних елемената[66]), или од више од једног природног изотопа. Нестабилни (радиоактивни) изотопи су или примордијални или постпримордијални. Примордијални изотопи су били производ звездане нуклеосинтезе или другог типа нуклеосинтезе као што је спалације космичких зрака,[67][68][69][70][71] и опстали су до сада јер је њихова брзина распадања тако спора (нпр. уранијум-238 и калијум-40). Пост-примордијални изотопи су створени бомбардовањем космичким зрацима као космогени нуклиди[72][73][74] (нпр. трицијум, угљеник-14), или распадом радиоактивног примордијалног изотопа до радиоактивне ћерке радиогеног нуклида[75][76][77][78] (нпр. уранијум у радијум). Неколико изотопа се природно синтетише као нуклеогени нуклиди, неком другом природном нуклеарном реакцијом, на пример када неутроне из природне нуклеарне фисије апсорбује други атом.
Као што је горе објашњено, само 80 елемената има стабилне изотопе, а 26 од њих има само један стабилан изотоп. Дакле, око две трећине стабилних елемената се природно јавља на Земљи у више стабилних изотопа, при чему је највећи број стабилних изотопа за елемент десет, за калај (Sn). Постоји око 94 елеменaта која се природно налазе на Земљи (до плутонијумa), мада се неки детектују само у веома малим количинама, као што је плутонијум-244. Научници процењују да се елементи који се природно јављају на Земљи (неки само као радиоизотопи) јављају као укупно 339 изотопа (нуклида).[79] Само 251 од ових природно присутних нуклида је стабилно, у смислу да никада није примећено да се распадају до сада. Додатних 35 примордијалних нуклида (до укупно 286 примордијалних нуклида) су радиоактивни са познатим полураспадом, али имају период полураспада дужи од 100 милиона година, што им омогућава да постоје од почетка Сунчевог система. За детаље погледајте списак нуклида.
Сви познати стабилни нуклиди се природно јављају на Земљи; остали природни нуклиди су радиоактивни, али се јављају на Земљи због њиховог релативно дугог полураспада, или због других видова текуће природне продукције. Ово укључује горе поменуте космогене нуклиде, нуклеогене нуклиде, и све радиогене нуклиде настале текућим распадом примордијалног радиоактивног нуклида, као што су радон и радијум из уранијума.
Додатних ~3000 радиоактивних нуклида који се не налазе у природи створено је у нуклеарним реакторима и у акцелераторима честица. Многи краткотрајни нуклиди који се природно не налазе на Земљи такође су примећени спектроскопском анализом, јер су природно створени у звездама или суперновама. Пример је алуминијум-26, који се природно не налази на Земљи, али се налази у изобиљу у астрономским размерама.
Табеларно приказане атомске масе елемената су просеци који објашњавају присуство више изотопа различитих маса. Пре открића изотопа, емпиријски одређене нецелобројне вредности атомске масе збуњивале су научнике. На пример, узорак хлора садржи 75,8% хлора-35 и 24,2% хлора-37, што даје просечну атомску масу од 35,5 јединица атомске масе.
Према општеприхваћеној космолошкој теорији, у Великом праску су настали само изотопи водоника и хелијума, трагови неких изотопа литијума и берилијума, а можда и нешто бора, док су сви остали нуклиди синтетисани касније, у звездама и суперновама и у интеракције између енергетских честица као што су космички зраци и претходно произведених нуклида. (Погледајте нуклеосинтезу за детаље о различитим процесима за које се сматра да су одговорни за производњу изотопа.) Одговарајуће обиље изотопа на Земљи произилази из количина које су формиране овим процесима, њиховог ширења кроз галаксију и стопа распада за изотопе који су нестабилни. Након почетне коалесценције Сунчевог система, изотопи су редистрибуирани према маси, а изотопски састав елемената незнатно варира од планете до планете. Ово понекад омогућава праћење порекла метеорита.
Атомска маса изотопа
уредиАтомска маса (mr) изотопа (нуклида) је одређена углавном његовим масеним бројем (тј. бројем нуклеона у његовом језгру). Мале корекције су последица енергије везивања језгра[80][81] (погледајте дефект масе[82][83][84]), мале разлике у маси између протона и неутрона и масе електрона повезаних са атомом, последњег јер се однос електрон:нуклеон разликује међу изотопима.
Масени број је бездимензионална величина. Атомска маса се, с друге стране, мери помоћу јединице атомске масе засноване на маси атома угљеника-12. Означава се симболима „u” (за јединствену јединицу атомске масе) или „Da” (за далтон[85][86]).
Атомске масе природних изотопа елемента одређују стандардну атомску тежину елемента.[87][88] Када елемент садржи N изотопа, доњи израз се примењује за просечну атомску масу :
где су m1, m2, ..., mN атомске масе сваког појединачног изотопа, а x1, ..., xN су релативне количине ових изотопа.
Употреба изотопа
уредиПостоји неколико примена, које користе својства различитих изотопа датог елемента. Једна од најчешћих примена је трејсер или маркер у техници званој изотопско обележавање. Изотопи датог елемента не могу се разликовати међусобно хемијским методама. Ипак, могу се разликовати коришћењем физичкохемијских метода, рецимо масене спектрометрије (директне разлике у маси), инфрацрвене спектроскопије (на основу вибрационих фреквенција у молекулу - тежи изотопи вибрирају нижим фреквенцијама од лакших), нуклеарне магнетне резонанције (на основу различитих жиромагнетних односа итд.
Пример коришћења изотопског обележавања је проучавање фенола (C6H5OH) у води. Након додавања фенола деутерисаној води (вода која садржи D2O осим уобичајеног H2O), истраживачи су приметили супституцију водоника деутеријумом у хидроксилној групи (C6H5OD), што значи да се фенол лако подвргава реакцијама размене водоника са водом. Само хидроксилна група је учествовала у реакцији, што значи да осталих 5 водоникових атома не учествују у реакцијама размене.
Изотопска измена се такође може користити да се одреде механизми реакције путем кинетичког изотопског ефекта (kinetic isotope effect).
Осим изотопског обележавања, неколико врста спектроскопије користи јединствена нуклеарна својства посебних изотопа. На пример, нуклеарно магнетно резонантна (НМР) спектроскопија се може користити само за изотопе са нуклеарним спином који није нула (nonzero). Изотопи који се најчешће користе у НМР спектроскопији су 1H, 2D, 13C, и 31P. Мисбауерова спектроскопија (Mossbauer spectroscopy) се заснива на детектовању нуклеарних прелаза одређених изотопа, рецимо 57Fe.
Изотопски састав елемената се разликује од планете до планете. Ова чињеница омогућава да се одреди порекло метеорита. Неки метеорити су класификовани као месечеви или Марсови метеорити.
Радиоактивни изотопи такође имају важне примене. Развој нуклеарне енергије и нуклеарног оружја захтевају знатно веће количине одређених изотопа. Процес сепарације изотопа представља значајан технолошки изазов.
Радиоизотопи се такође често користе у медицини, биохемији, и хемији као трејсери. Мале количине радиоизотопа могу лако да се детектују због карактеристичних емисија распадајућег језгра.
Природни радиоактивни распад 14C омогућава радиоугљенично датирање. Космички зраци стварају изотоп 14C у атмосфери тако што у судару са језгрима из ваздуха избијају слободне неутроне. Ти неутрони могу језгро азота из молекула азота (N2) да трансформишу у изотоп угљеника 14C:
- 1n + 14N → 14C + 1p
Овај изотоп се на крају угради у молекул угљендиоксида и тако доспева у биљке, а преко њих и у животиње. Изотоп 14C се, дакле, у природи стално ствара (због космичких зрака) и распада (због нестабилности) те је његова концентрација у живим организмима константна. Међутим, у неживом свету нема размене угљендиоксида те концентрација 14C опада са временом. Дакле, мерењем преостале радиоактивности 14C у биолошком узорку, може да се утврди време када је кружење угљеника заустављено (када је животиња угинула, дрво посечено, биљка убрана...).
Због стабилности и природне распрострањености, изотоп 12C је изабран као стандард за јединицу атомске масе, (дванаестина масе изотопа 12C) а онда такође у дефиницији мола, у основним јединицама СИ система.
Пречишћавање изотопа
уредиПостоји неколико апликација које користе својства различитих изотопа датог елемента. Одвајање изотопа је значајан технолошки изазов,[89] посебно са тешким елементима као што су уранијум или плутонијум.[90] Лакши елементи као што су литијум, угљеник, азот и кисеоник се обично одвајају дифузијом гаса њихових једињења као што су CO и NO. Одвајање водоника и деутеријума је необично јер се заснива на хемијским, а не физичким својствима, на пример у Гирдлеровом сулфидном процесу.[91][92][93][94] Изотопи уранијума су одвојени у расутом стању дифузијом гаса, гасним центрифугирањем, ласерском јонизационом сепарацијом и (у Пројекту Менхетн) врстом производне масене спектрометрије.
Коришћење хемијских и биолошких својстава
уреди- Анализа изотопа је одређивање изотопског потписа,[95][96][97] релативне заступљености изотопа датог елемента у одређеном узорку.[98][99][100][101][102][103] Анализа изотопа се често ради масеном спектрометријом односа изотопа.[104][105][106] Нарочито за биогене супстанце могу се јавити значајне варијације изотопа C, N, и O. Анализа таквих варијација има широк спектар примена, као што је откривање фалсификата у прехрамбеним производима[107] или географско порекло производа коришћењем изоскејпа.[108][109][110][111][112][113] Идентификација одређених метеорита насталих од Марса је делимично заснована на изотопском потпису гасова у траговима који се налазе у њима.[114][115][116]
- Изотопска супституција се може користити за одређивање механизма хемијске реакције путем кинетичког изотопског ефекта.[117][118][119][120][121]
- Још једна уобичајена примена је изотопско обележавање, коришћење необичних изотопа као трагача или маркера у хемијским реакцијама.[122] Обично се атоми датог елемента не разликују један од другог. Међутим, коришћењем изотопа различитих маса, чак и различити нерадиоактивни стабилни изотопи могу се разликовати масеном спектрометријом или инфрацрвеном спектроскопијом. На пример, у „обележавању стабилних изотопа аминокиселинама у ћелијској култури (SILAC[123][124][125][126][127])“ стабилни изотопи се користе за квантификацију протеина. Ако се користе радиоактивни изотопи, они се могу детектовати по зрачењу које емитују (ово се зове радиоизотопско обележавање).
- Изотопи се обично користе за одређивање концентрације различитих елемената или супстанци помоћу методе разблаживања изотопа,[128][129] при чему се познате количине изотопски супституисаних једињења мешају са узорцима, а изотопски потписи добијених смеша се одређују масеном спектрометријом.
Коришћење нуклеарних својстава
уреди- Техника слична обележавању радиоизотопа је радиометријско датирање: коришћењем познатог полуживота нестабилног елемента, може се израчунати количина времена која је протекла од постојања познате концентрације изотопа. Најпознатији пример је радиокарбонско датирање које се користи за одређивање старости угљеничних материјала.
- Неколико облика спектроскопије ослања се на јединствена нуклеарна својства специфичних изотопа, радиоактивних и стабилних. На пример, спектроскопија нуклеарне магнетне резонанце (NMR) се може користити само за изотопе са нуклеарним спином који није нула. Најчешћи нуклиди који се користе у NMR спектроскопији су 1H, 2D, 15N, 13C, и 31P.
- Мисбауерова спектроскопија се такође ослања на нуклеарне прелазе специфичних изотопа, као што је 57Fe.[130][131][132][133]
- Радионуклиди такође имају важну употребу. Нуклеарна енергија[134][135][136] и развој нуклеарног оружја захтевају релативно велике количине специфичних изотопа. Нуклеарна медицина и радијациона онкологија[137][137][138][139][140] користе радиоизотопе за медицинску дијагнозу и лечење.
Види још
уреди- Табела изотопа (подељена) - табела свих познатих изотопа
- Табела изотопа (комплетна)
- Листа честица
- Изотопи су нуклиди који имају исти број протона; упореди:
- Изотони су нуклиди који имају исти број неутрона.
- Изобари су нуклиди који имају исти масени број то јест збир протона и неутрона.
- Нуклеарни изомери су различита побуђена стања истог типа језгра. Промена једног изомера у други је праћена емисијом или апсорпцијом гама зрака, или процесом интерне конверзије. (не треба мешати са хемијским изомерима.)
Референце
уреди- ^ Herzog, Gregory F. (2. 6. 2020). „Isotope”. Encyclopedia Britannica.
- ^ IUPAC (Connelly, N. G.; Damhus, T.; Hartshorn, R. M.; and Hutton, A. T.), Nomenclature of Inorganic Chemistry – IUPAC Recommendations 2005, The Royal Society of Chemistry, 2005; IUPAC (McCleverty, J. A.; and Connelly, N. G.), Nomenclature of Inorganic Chemistry II. Recommendations 2000, The Royal Society of Chemistry, 2001; IUPAC (Leigh, G. J.), Nomenclature of Inorganic Chemistry (recommendations 1990), Blackwell Science, 1990; IUPAC, Nomenclature of Inorganic Chemistry, Second Edition Архивирано на сајту Wayback Machine (3. март 2016), 1970; probably in the 1958 first edition as well
- ^ „NuDat 2 Description”. Архивирано из оригинала 23. 12. 2016. г. Приступљено 2. 1. 2016.
- ^ Soddy, Frederick (1913). „Intra-atomic charge”. Nature. 92 (2301): 399—400. Bibcode:1913Natur..92..399S. S2CID 3965303. doi:10.1038/092399c0.
- ^ „IUPAP Red Book” (PDF). Архивирано из оригинала (PDF) 2015-03-18. г. Приступљено 2018-01-06.
- ^ а б IUPAC Gold Book
- ^ IUPAC (Connelly, N. G.; Damhus, T.; Hartshorn, R. M.; and Hutton, A. T.), Nomenclature of Inorganic Chemistry – IUPAC Recommendations 2005, The Royal Society of Chemistry, 2005; IUPAC (McCleverty, J. A.; and Connelly, N. G.), Nomenclature of Inorganic Chemistry II. Recommendations 2000, The Royal Society of Chemistry, 2001; IUPAC (Leigh, G. J.), Nomenclature of Inorganic Chemistry (recommendations 1990), Blackwell Science, 1990; IUPAC, Nomenclature of Inorganic Chemistry, Second Edition Архивирано 2016-03-03 на сајту Wayback Machine, 1970; probably in the 1958 first edition as well
- ^ This notation seems to have been introduced in the second half of the 1930s. Before that, various notations were used, such as Ne(22) for neon-22 (1934), Ne22 for neon-22 (1935), or even Pb210 for lead-210 (1933).
- ^ Samir Maji; et al. (2006). „Separation of samarium and neodymium: a prerequisite for getting signals from nuclear synthesis”. Analyst. 131 (12): 1332—1334. Bibcode:2006Ana...131.1332M. PMID 17124541. doi:10.1039/b608157f.
- ^ Hoffman, D. C.; Lawrence, F. O.; Mewherter, J. L.; Rourke, F. M. (1971). „Detection of Plutonium-244 in Nature”. Nature. 234 (5325): 132—134. Bibcode:1971Natur.234..132H. S2CID 4283169. doi:10.1038/234132a0.
- ^ Lachner, J.; et al. „Attempt to detect primordial 244Pu on Earth”. Physical Review C. 85 (1): 015801. Bibcode:2012PhRvC..85a5801L. doi:10.1103/PhysRevC.85.015801.
- ^ Wu, Yang; Dai, Xiongxin; Xing, Shan; Luo, Maoyi; Christl, Marcus; Synal, Hans-Arno; Hou, Shaochun. „Direct search for primordial 244Pu in Bayan Obo bastnaesite”. Chinese Chemical Letters. 33 (7): 3522—3526. doi:10.1016/j.cclet.2022.03.036. Приступљено 29. 1. 2024.
- ^ Belli, P.; Bernabei, R.; Danevich, F. A.; et al. (2019). „Experimental searches for rare alpha and beta decays”. European Physical Journal A. 55 (8): 140—1—140—7. Bibcode:2019EPJA...55..140B. ISSN 1434-601X. S2CID 201664098. arXiv:1908.11458 . doi:10.1140/epja/i2019-12823-2.
- ^ Bajc, Borut; Hisano, Junji; Kuwahara, Takumi; Omura, Yuji (2016). „Threshold corrections to dimension-six proton decay operators in non-minimal SUSY SU(5) GUTs”. Nuclear Physics B. 910: 1. Bibcode:2016NuPhB.910....1B. S2CID 119212168. arXiv:1603.03568 . doi:10.1016/j.nuclphysb.2016.06.017.
- ^ Francis, Matthew R. (22. 9. 2015). „Do protons decay?”. symmetry magazine (на језику: енглески). Приступљено 2020-11-12.
- ^ Talou, P.; Carjan, N.; Strottman, D. (1998). „Time-dependent properties of proton decay from crossing single-particle metastable states in deformed nuclei”. Physical Review C. 58 (6): 3280—3285. Bibcode:1998PhRvC..58.3280T. S2CID 119075457. arXiv:nucl-th/9809006 . doi:10.1103/PhysRevC.58.3280.
- ^ Dicus, D. A.; Letaw, J. R.; Teplitz, D. C.; Teplitz, V. L. (јануар 1982). „Effects of proton decay on the cosmological future”. The Astrophysical Journal (на језику: енглески). 252: 1. Bibcode:1982ApJ...252....1D. ISSN 0004-637X. doi:10.1086/159528.
- ^ Trixler, F. (2013). „Quantum Tunnelling to the Origin and Evolution of Life”. Current Organic Chemistry. 17 (16): 1758—1770. PMC 3768233 . PMID 24039543. doi:10.2174/13852728113179990083.
- ^ „NuDat 2 Description”. Архивирано из оригинала 23. 12. 2016. г. Приступљено 2. 1. 2016.
- ^ Yan, X.; Cheng, Z.; Abdukerim, A.; et al. (2024). „Searching for two-neutrino and neutrinoless double beta decay of 134Xe with the PandaX-4T experiment”. Physical Review Letters. 132 (152502). arXiv:2312.15632 . doi:10.1103/PhysRevLett.132.152502.
- ^ Beeman, J. W.; Bellini, F.; Cardani, L.; Casali, N.; Di Domizio, S.; Fiorini, E.; Gironi, L.; Nagorny, S. S.; Nisi, S.; Orio, F.; Pattavina, L.; Pessina, G.; Piperno, G.; Pirro, S.; Previtali, E.; Rusconi, C.; Tomei, C.; Vignati, M. (2013). „New experimental limits on the α decays of lead isotopes”. The European Physical Journal A. 49 (4). ISSN 1434-6001. arXiv:1212.2422 . doi:10.1140/epja/i2013-13050-7.
- ^ Akerib, D S; et al. (2020-10-01). „Search for two neutrino double electron capture of 124Xe and 126Xe in the full exposure of the LUX detector”. Journal of Physics G: Nuclear and Particle Physics. 47 (10): 105105. ISSN 0954-3899. arXiv:1912.02742 . doi:10.1088/1361-6471/ab9c2d.
- ^ Belli, P.; Bernabei, R.; Cappella, F.; Cerulli, R.; Danevich, F. A.; d’Angelo, S.; Incicchitti, A.; Kovtun, G. P.; Kovtun, N. G.; Laubenstein, M.; Poda, D. V.; Polischuk, O. G.; Shcherban, A. P.; Solopikhin, D. A.; Suhonen, J.; Tretyak, V. I. (2013-03-06). „Search for 2 β decays of 96 Ru and 104 Ru by ultralow-background HPGe γ spectrometry at LNGS: Final results”. Physical Review C. 87 (3). ISSN 0556-2813. arXiv:1302.7134 . doi:10.1103/PhysRevC.87.034607.
- ^ Danevich, F. A.; Hult, M.; Junghans, A.; Kasperovych, D. V.; Kropivyansky, B. N.; Lutter, G.; Marissens, G.; Polischuk, O. G.; Romaniuk, M. V.; Stroh, H.; Tessalina, S.; Tretyak, V. I.; Ware, B. (2022). „New limits on double-beta decay of 190Pt and 198Pt”. The European Physical Journal C. 82 (1). ISSN 1434-6044. arXiv:2201.06555 . doi:10.1140/epjc/s10052-022-09989-1.
- ^ Belli, P.; Bernabei, R.; Boiko, R. S.; Cappella, F.; Caracciolo, V.; Cerulli, R.; Danevich, F. A.; Di Marco, A.; Incicchitti, A.; Kropivyansky, B. N.; Laubenstein, M.; Nisi, S.; Poda, D. V.; Polischuk, O. G.; Tretyak, V. I. (2019). „First direct search for 2ϵ and ϵβ+ of 144Sm and 2β- decay of 154Sm”. The European Physical Journal A. 55 (11). ISSN 1434-6001. arXiv:1910.02262 . doi:10.1140/epja/i2019-12911-3.
- ^ Arnquist, I. J.; Avignone III, F. T.; Barabash, A. S.; Barton, C. J.; Bhimani, K. H.; Blalock, E.; Bos, B.; Busch, M.; Buuck, M.; Caldwell, T. S.; Christofferson, C. D.; Chu, P.-H.; Clark, M. L.; Cuesta, C.; Detwiler, J. A.; Efremenko, Yu.; Ejiri, H.; Elliott, S. R.; Giovanetti, G. K.; Goett, J.; Green, M. P.; Gruszko, J.; Guinn, I. S.; Guiseppe, V. E.; Haufe, C. R.; Henning, R.; Aguilar, D. Hervas; Hoppe, E. W.; Hostiuc, A.; Kim, I.; Kouzes, R. T.; Lannen V., T. E.; Li, A.; López-Castaño, J. M.; Massarczyk, R.; Meijer, S. J.; Meijer, W.; Oli, T. K.; Paudel, L. S.; Pettus, W.; Poon, A. W. P.; Radford, D. C.; Reine, A. L.; Rielage, K.; Rouyer, A.; Ruof, N. W.; Schaper, D. C.; Schleich, S. J.; Smith-Gandy, T. A.; Tedeschi, D.; Thompson, J. D.; Varner, R. L.; Vasilyev, S.; Watkins, S. L.; Wilkerson, J. F.; Wiseman, C.; Xu, W.; Yu, C.-H. (13. 10. 2023). „Constraints on the Decay of 180mTa”. Phys. Rev. Lett. 131 (15): 152501. arXiv:2306.01965 . doi:10.1103/PhysRevLett.131.152501.
- ^ Choppin, G.; Liljenzin, J. O. and Rydberg, J. (1995) Radiochemistry and Nuclear Chemistry (2nd ed.) Butterworth-Heinemann, pp. 3–5
- ^ Others had also suggested the possibility of isotopes; for example:
- Strömholm, Daniel and Svedberg, Theodor (1909) „Untersuchungen über die Chemie der radioactiven Grundstoffe II.”. Zeitschrift für anorganischen Chemie. 63: 197—206. (Investigations into the chemistry of the radioactive elements, part 2). ; see especially page 206.
- Alexander Thomas Cameron (1910). Radiochemistry. London, England: J. M. Dent & Sons. стр. 141.. (Cameron also anticipated the displacement law.)
- ^ а б в Ley, Willy (октобар 1966). „The Delayed Discovery”. For Your Information. Galaxy Science Fiction. стр. 116—127.
- ^ а б в Scerri, Eric R (2007). The Periodic Table. Oxford University Press, USA. стр. 176—179. ISBN 978-0-19-530573-9.
- ^ а б Nagel, Miriam C. (1982). „Frederick Soddy: From Alchemy to Isotopes”. Journal of Chemical Education. 59 (9): 739—740. Bibcode:1982JChEd..59..739N. doi:10.1021/ed059p739.
- ^ Kasimir Fajans (1913) „Über eine Beziehung zwischen der Art einer radioaktiven Umwandlung und dem elektrochemischen Verhalten der betreffenden Radioelemente”. Physikalische Zeitschrift. 14: 131—136. (On a relation between the type of radioactive transformation and the electrochemical behavior of the relevant radioactive elements), .
- ^ Soddy announced his "displacement law". Soddy, Frederick (1913). „The Radio-Elements and the Periodic Law”. Nature. 91 (2264): 57—58. Bibcode:1913Natur..91...57S. S2CID 3975657. doi:10.1038/091057a0..
- ^ Soddy elaborated his displacement law in: Soddy, Frederick. „Radioactivity”. Chemical Society Annual Report. 10: 262—288. 1913..
- ^ Alexander Smith Russell (1888–1972) also published a displacement law: Russell, Alexander S. „The periodic system and the radio-elements”. Chemical News and Journal of Industrial Science. 107: 49—52. 1913..
- ^ Soddy first used the word "isotope". Soddy, Frederick (1913). „Intra-atomic charge”. Nature. 92 (2301): 399—400. Bibcode:1913Natur..92..399S. S2CID 3965303. doi:10.1038/092399c0.
- ^ Fleck, Alexander (1957). „Frederick Soddy”. Biographical Memoirs of Fellows of the Royal Society. 3: 203—216. doi:10.1098/rsbm.1957.0014 . „p. 208: Up to 1913 we used the phrase 'radio elements chemically non-separable' and at that time the word isotope was suggested in a drawing-room discussion with Dr. Margaret Todd in the home of Soddy's father-in-law, Sir George Beilby.”
- ^ Budzikiewicz H, Grigsby RD (2006). „Mass spectrometry and isotopes: a century of research and discussion”. Mass Spectrometry Reviews. 25 (1): 146—57. Bibcode:2006MSRv...25..146B. PMID 16134128. doi:10.1002/mas.20061.
- ^ Scerri, Eric R (2007). „6”. The Periodic Table. Oxford University Press. ISBN 978-0-19-530573-9.. note 44 (p. 312) citing Alexander Fleck, described as a former student of Soddy's.
- ^ In his 1893 book, William T. Preyer also used the word "isotope" to denote similarities among elements. From Preyer, William T. (1893). Das genetische System der chemischen Elemente.. )
- ^ Soddy, Frederick (12. 12. 1922). „The origins of the conceptions of isotopes” (PDF). Nobelprize.org. стр. 393. Приступљено 9. 1. 2019. „Thus the chemically identical elements - or isotopes, as I called them for the first time in this letter to Nature, because they occupy the same place in the Periodic Table ...”
- ^ „isotope—Origin and meaning”. www.etymonline.com (на језику: енглески). Приступљено 21. 10. 2021.
- ^ Thomson, J. J. (1912). „XIX. Further experiments on positive rays”. Philosophical Magazine. Series 6. 24 (140): 209—253. doi:10.1080/14786440808637325.
- ^ J. J. Thomson (1913). „Rays of positive electricity”. Proceedings of the Royal Society A. 89: 1—20..
- ^ Aston, F. W. (1920). „Isotopes and Atomic Weights”. Nature. 105 (2646): 617—619. S2CID 4267919. doi:10.1038/105617a0.
- ^ Mass spectra and isotopes Francis W. Aston, Nobel prize lecture 1922
- ^ Chadwick, James (1932). „Existence of a Neutron”. Proceedings of the Royal Society A. 136 (830): 692—708. Bibcode:1932RSPSA.136..692C. doi:10.1098/rspa.1932.0112 .
- ^ Atkins P, de Paula J (2006). Atkins' Physical Chemistry (8th изд.). Oxford University Press. стр. 286–288, 816–818. ISBN 978-0-19-870072-2.
- ^ Westaway, Kenneth C. (2006). „Using kinetic isotope effects to determine the structure of the transition states of SN. 2 reactions”. Advances in Physical Organic Chemistry. 41: 217—273. ISBN 978-0-12-033541-1. doi:10.1016/S0065-3160(06)41004-2.
- ^ Lynn KR, Yankwich PE (5. 8. 1961). „Isotope Fractionation at the Methyl Carbon in the Reactions of Cyanide Ion with Methyl Chloride and Methyl Bromide”. Journal of the American Chemical Society. 83 (15): 3220—3223. Bibcode:1961JAChS..83.3220L. doi:10.1021/ja01476a012.
- ^ Laidler, Keith (1987). Chemical Kinetics (на језику: енглески) (3rd изд.). India: Pearson Education. стр. 427. ISBN 978-81-317-0972-6.
- ^ Laidler K.J. (1987). Chemical Kinetics (3rd изд.). Harper & Row. стр. 428–433. ISBN 0-06-043862-2.
- ^ Seeman, Jeffrey I.; Secor, Henry V.; Disselkamp, R.; Bernstein, E. R. (1992). „Conformational analysis through selective isotopic substitution: supersonic jet spectroscopic determination of the minimum energy conformation of o-xylene”. Journal of the Chemical Society, Chemical Communications (9): 713. doi:10.1039/C39920000713.
- ^ Seeman, Jeffrey I.; Paine, III, John B. (7. 12. 1992). „Letter to the Editor: 'Isotopomers, Isotopologs'”. Chemical & Engineering News. American Chemical Society. 70 (2). doi:10.1021/cen-v070n049.p002 .
- ^ Sonzogni, Alejandro (2008). „Interactive Chart of Nuclides”. National Nuclear Data Center: Brookhaven National Laboratory. Архивирано из оригинала 2018-10-10. г. Приступљено 2013-05-03.
- ^ Schunck, Nicolas; Regnier, David (1. 7. 2022). „Theory of nuclear fission”. Progress in Particle and Nuclear Physics. 125. Bibcode:2022PrPNP.12503963S. arXiv:2201.02719 . doi:10.1016/j.ppnp.2022.103963 .
- ^ Krane, Kenneth S. (1988). Introductory nuclear physics. Hoboken, NJ: Wiley. ISBN 9780471805533.
- ^ Poenaru, Dorin N.; Greiner, Walter (2011). „Cluster Radioactivity”. Clusters in Nuclei I. Lecture Notes in Physics. 818. Berlin: Springer. стр. 1—56. ISBN 978-3-642-13898-0.
- ^ Poenaru, D. N.; Greiner, W. (1996). Nuclear Decay Modes. Bristol: Institute of Physics Publishing. стр. 1—577. ISBN 978-0-7503-0338-5.
- ^ Gamow, George (1930). „Mass Defect Curve and Nuclear Constitution”. Proceedings of the Royal Society A. 126 (803): 632—644. Bibcode:1930RSPSA.126..632G. JSTOR 95297. doi:10.1098/rspa.1930.0032 .
- ^ von Weizsäcker, C. F. (1935). „Zur Theorie der Kernmassen”. Zeitschrift für Physik (на језику: немачки). 96 (7–8): 431—458. Bibcode:1935ZPhy...96..431W. S2CID 118231854. doi:10.1007/BF01337700.
- ^ Hult, Mikael; Wieslander, J. S.; Marissens, Gerd; Gasparro, Joël; Wätjen, Uwe; Misiaszek, Marcin (2009). „Search for the radioactivity of 180mTa using an underground HPGe sandwich spectrometer”. Applied Radiation and Isotopes. 67 (5): 918—21. PMID 19246206. doi:10.1016/j.apradiso.2009.01.057.
- ^ de Broglie, Louis. „On the Theory of Quanta” (PDF). aflb.ensmp.fr. Приступљено 2. 2. 2019.
- ^ Carron, N.J. (2007). An Introduction to the Passage of Energetic Particles Through Matter. стр. 308. Bibcode:2007ipep.book.....C.
- ^ „Neutron Energy”. www.nuclear-power.net. Приступљено 27. 1. 2019.
- ^ Шаблон:Housecroft4th
- ^ Sapphire Lally (24. 7. 2021). „How is gold made? The mysterious cosmic origins of heavy elements”. New Scientist.
- ^ Coc, A.; Olive, K. A.; Uzan, J.-P.; Vangioni, E. (2012). „Variation of fundamental constants and the role of A = 5 and A = 8 nuclei on primordial nucleosynthesis”. Physical Review D. 86 (4): 043529. Bibcode:2012PhRvD..86d3529C. S2CID 119230483. arXiv:1206.1139 . doi:10.1103/PhysRevD.86.043529.
- ^ Starrfield, Sumner (27. 5. 2020). „Carbon–Oxygen Classical Novae Are Galactic 7Li Producers as well as Potential Supernova Ia Progenitors”. The Astrophysical Journal. 895 (1): 70. S2CID 203610207. arXiv:1910.00575 . doi:10.3847/1538-4357/ab8d23 .
- ^ Greenwood, N. N.; Earnshaw, A. (1998). Chemistry of the Elements (2nd изд.). Butterworth-Heinemann. ISBN 978-0-7506-3365-9.
- ^ Meneguzzi, M.; Audouze, J.; Reeves, H. (1971). „The production of the elements Li, Be, B by galactic cosmic rays in space and its relation with stellar observations”. Astronomy and Astrophysics. 15: 337. Bibcode:1971A&A....15..337M.
- ^ Sapphire Lally (24. 7. 2021). „How is gold made? The mysterious cosmic origins of heavy elements”. New Scientist.
- ^ Schaefer, Joerg M.; Codilean, Alexandru T.; Willenbring, Jane K.; Lu, Zheng-Tian; Keisling, Benjamin; Fülöp, Réka-H.; Val, Pedro (2022-03-10). „Cosmogenic nuclide techniques”. Nature Reviews Methods Primers (на језику: енглески). 2 (1): 1—22. ISSN 2662-8449. S2CID 247396585. doi:10.1038/s43586-022-00096-9.
- ^ Lal, D.; Peters, B. (1967). „Cosmic Ray Produced Radioactivity on the Earth”. Kosmische Strahlung II / Cosmic Rays II. Handbuch der Physik / Encyclopedia of Physics. 9 / 46 / 2. стр. 551—612. ISBN 978-3-642-46081-4. doi:10.1007/978-3-642-46079-1_7.
- ^ Dickin, A.P. (2018). Radiogenic Isotope Geology. Cambridge University Press. doi:10.1017/9781316163009.
- ^ Allaby, Alisa; Michael Allaby (1999). „radiogenic heating”. A Dictionary of Earth Sciences. Приступљено 24. 11. 2013.
- ^ Mutter, John C. „The Earth as a Heat Engine”. Introduction to Earth Sciences I. Columbia University. стр. 3.2 Mantle convection. Приступљено 23. 11. 2013.
- ^ Dumé, Belle (27. 7. 2005). „Geoneutrinos make their debut; Radiogenic heat in the Earth”. Physics World. Institute of Physics. Архивирано из оригинала 07. 05. 2017. г. Приступљено 23. 11. 2013.
- ^ „Radioactivity and earth sciences: Understanding the natural environment” (PDF). Приступљено 2024-09-24.
- ^ Rohlf, James William (1994). Modern Physics from α to Z°. John Wiley & Sons. стр. 20. ISBN 0471572705.
- ^ Eisberg, Robert; Resnick, Robert (1985). Quantum Physics of Atoms, Molecules, Solids, Nuclei, and Particles (2nd изд.). John Wiley & Sons. стр. 524. ISBN 047187373X.
- ^ Frisch, David H.; Thorndike, Alan M. (1964). Elementary Particles. Princeton, New Jersey: David Van Nostrand. стр. 11—12.
- ^ „20.8: Converting Mass to Energy: Mass Defect and Nuclear Binding Energy”. Chemistry LibreTexts (на језику: енглески). 2016-03-11. Приступљено 2019-11-05.
- ^ Pourshahian, Soheil (2017-09-01). „Mass Defect from Nuclear Physics to Mass Spectral Analysis”. Journal of the American Society for Mass Spectrometry (на језику: енглески). 28 (9): 1836—1843. Bibcode:2017JASMS..28.1836P. ISSN 1879-1123. PMID 28733967. S2CID 34178643. doi:10.1007/s13361-017-1741-9.
- ^ Smith, R. Angus (1856). Memoir of John Dalton and History of the Atomic Theory. London: H. Bailliere. стр. 279. ISBN 978-1-4021-6437-8. Архивирано из оригинала 15. 8. 2022. г. Приступљено 24. 12. 2007.
- ^ „John Dalton: atoms, eyesight and auroras”. Science and Industry Museum. Архивирано из оригинала 24. 6. 2021. г. Приступљено 21. 6. 2021.
- ^ Wieser, M. E (2006). „Atomic weights of the elements 2005 (IUPAC Technical Report)” (PDF). Pure and Applied Chemistry. 78 (11): 2051—2066. S2CID 94552853. doi:10.1351/pac200678112051.
- ^ „IUPAC Goldbook”. Compendium of Chemical Terminology. doi:10.1351/goldbook.S05907 . Приступљено 12. 7. 2019. „standard atomic weights: Recommended values of relative atomic masses of the elements revised biennially by the IUPAC Commission on Atomic Weights and Isotopic Abundances and applicable to elements in any normal sample with a high level of confidence. A normal sample is any reasonably possible source of the element or its compounds in commerce for industry and science and has not been subject to significant modification of isotopic composition within a geologically brief period.”
- ^ Thomas, Andrew (30. 11. 2000). „AMD tests 'super silicon' to beat heat problems”. The Register: Channel. The Register. Приступљено 17. 1. 2014.
- ^ Garwin, Richard L. (новембар 1997). „The Technology of Nuclear Weapons”. Arms Control Today. 27 (8): 6—7 — преко Proquest.
- ^ Castell, Lutz (2003). Time, Quantum and Information. Google Books: Springer Science+Business Media. стр. 37. ISBN 978-3-642-07892-7.
- ^ „Bruce Heavy Water Plant Decommissioning” (PDF).
- ^ „Heavy Water Board – A unit under Department of Atomic Energy, Govt. of India<”. Архивирано из оригинала 12. 10. 2007. г.
- ^ Rae, H. K. (1978). „Selecting Heavy Water Processes”. Separation of Hydrogen Isotopes. ACS Symposium Series. 68. стр. 1—26. ISBN 978-0-8412-0420-1. doi:10.1021/bk-1978-0068.ch001.
- ^ Hanson, James Ralph (2011). The organic chemistry of isotopic labelling. Cambridge: Royal society of chemistry. ISBN 978-1-84973-188-1.
- ^ Blake, Michael E.; Bartlett, Kevin L.; Jones, Maitland (2003). „Am-Benzyne too-Benzyne Conversion through a 1,2-Shift of a Phenyl Group”. Journal of the American Chemical Society. 125 (21): 6485—6490. ISSN 0002-7863. PMID 12785789. doi:10.1021/ja0213672.
- ^ Kruger, Nicholas; Antje von Schaewen (2003). „The oxidative pentose phosphate pathway: structure and organisation” (PDF). Current Opinion in Plant Biology. 6 (3): 236—246. Bibcode:2003COPB....6..236K. PMID 12753973. doi:10.1016/s1369-5266(03)00039-6. Архивирано из оригинала (PDF) 15. 4. 2012. г.
- ^ Nobel, Park S. (7. 2. 2005). Physicochemical and Environmental Plant Physiology. Academic Press. стр. 411. ISBN 978-0-12-520026-4.
- ^ Fernandez, Irene; Cadisch, Georg (2003). „Discrimination against13C during degradation of simple and complex substrates by two white rot fungi”. Rapid Communications in Mass Spectrometry. 17 (23): 2614—2620. Bibcode:2003RCMS...17.2614F. ISSN 0951-4198. PMID 14648898. doi:10.1002/rcm.1234.
- ^ Fernandez, I.; Mahieu, N.; Cadisch, G. (2003). „Carbon isotopic fractionation during decomposition of plant materials of different quality”. Global Biogeochemical Cycles. 17 (3): n/a. Bibcode:2003GBioC..17.1075F. ISSN 0886-6236. doi:10.1029/2001GB001834 .
- ^ Farquhar, G D; Ehleringer, J R; Hubick, K T (1989). „Carbon Isotope Discrimination and Photosynthesis”. Annual Review of Plant Physiology and Plant Molecular Biology. 40 (1): 503—537. ISSN 1040-2519. S2CID 12988287. doi:10.1146/annurev.pp.40.060189.002443.
- ^ McCarroll, Danny; Loader, Neil J. (2004). „Stable isotopes in tree rings”. Quaternary Science Reviews. 23 (7–8): 771—801. Bibcode:2004QSRv...23..771M. CiteSeerX 10.1.1.336.2011 . ISSN 0277-3791. doi:10.1016/j.quascirev.2003.06.017.
- ^ Ewe, Sharon M.L; da Silveira Lobo Sternberg, Leonel; Busch, David E (1999). „Water-use patterns of woody species in pineland and hammock communities of South Florida”. Forest Ecology and Management. 118 (1–3): 139—148. Bibcode:1999ForEM.118..139E. ISSN 0378-1127. doi:10.1016/S0378-1127(98)00493-9 .
- ^ Paul D, Skrzypek G, Fórizs I (2007). „Normalization of measured stable isotopic compositions to isotope reference scales - a review”. Rapid Commun. Mass Spectrom. 21 (18): 3006—14. Bibcode:2007RCMS...21.3006P. PMID 17705258. doi:10.1002/rcm.3185.
- ^ Stellaard F, Elzinga H (2005). „Analytical techniques in biomedical stable isotope applications: (isotope ratio) mass spectrometry or infrared spectrometry?”. Isotopes in Environmental and Health Studies. 41 (4): 345—61. PMID 16543190. doi:10.1080/10256010500384333.
- ^ Dickin, A.P. (2005). Radiogenic Isotope Geology. Cambridge University Press. Архивирано из оригинала 2014-03-27. г. Приступљено 2008-10-09.
- ^ Jamin, Eric; Guérin, Régis; Rétif, Mélinda; Lees, Michèle; Martin, Gérard J. (2003). „Improved Detection of Added Water in Orange Juice by Simultaneous Determination of the Oxygen-18/Oxygen-16 Isotope Ratios of Water and Ethanol Derived from Sugars”. J. Agric. Food Chem. 51 (18): 5202—6. PMID 12926859. doi:10.1021/jf030167m.
- ^ „First appearance of "isoscapes" at a scientific meeting”.
- ^ „Peer-reviewed article that discusses isoscapes”.
- ^ „Isoscapes to Address Large-Scale Earth Science Challenges”. Eos, transactions, American Geophysical Union. св. 90 бр. 13. 2009. стр. 109—116. doi:10.1029/2009EO130001 .
- ^ Dutton, Andrea; Wilkinson, Bruce H.; Welker, Jeffrey M.; Bowen, Gabriel J.; Lohmann, Kyger C. (2005-12-30). „Spatial distribution and seasonal variation in 18 O/ 16 O of modern precipitation and river water across the conterminous USA”. Hydrological Processes (на језику: енглески). 19 (20): 4121—4146. S2CID 54706113. doi:10.1002/hyp.5876. hdl:2027.42/49284 .
- ^ Bowen, Gabriel J.; Wassenaar, Leonard I.; Hobson, Keith A. (април 2005). „Global application of stable hydrogen and oxygen isotopes to wildlife forensics”. Oecologia (на језику: енглески). 143 (3): 337—348. ISSN 0029-8549. PMID 15726429. S2CID 1762342. doi:10.1007/s00442-004-1813-y.
- ^ Kendall, Carol; Coplen, Tyler B. (мај 2001). „Distribution of oxygen-18 and deuterium in river waters across the United States”. Hydrological Processes (на језику: енглески). 15 (7): 1363—1393. ISSN 0885-6087. S2CID 27744095. doi:10.1002/hyp.217.
- ^ Treiman, A. H.; Gleason, J. D.; Bogard, D. D. (2000). „The SNC meteorites are from Mars”. Planet. Space Sci. 48 (12–14): 1213. Bibcode:2000P&SS...48.1213T. doi:10.1016/S0032-0633(00)00105-7.
- ^ „Search results for 'Martian meteorites'”. Meteoritical Bulletin. Meteoritical Society. Приступљено 27. 4. 2020.
- ^ Staff (3. 1. 2013). „Researchers Identify Water Rich Meteorite Linked To Mars Crust”. NASA. Архивирано из оригинала 29. 5. 2018. г. Приступљено 3. 1. 2013.
- ^ Westaway, Kenneth C. (2006). „Using kinetic isotope effects to determine the structure of the transition states of SN. 2 reactions”. Advances in Physical Organic Chemistry. 41: 217—273. ISBN 978-0-12-033541-1. doi:10.1016/S0065-3160(06)41004-2.
- ^ Poirier RA, Wang Y, Westaway KC (март 1994). „A Theoretical Study of the Relationship between Secondary .alpha.-Deuterium Kinetic Isotope Effects and the Structure of SN. 2 Transition States”. Journal of the American Chemical Society. 116 (6): 2526—2533. doi:10.1021/ja00085a037.
- ^ Buncel E, Lee CC (1977). Isotopes in cationic reactions . Isotopes in Organic Chemistry. 5. Amsterdam: Elsevier. ISBN 978-0-444-41927-9. OCLC 867217247.
- ^ Melander L, Saunders WH (1980). Reaction Rates of Isotopic Molecules. New York: Wiley.
- ^ Bigeleisen J, Wolfsberg M (јануар 1957). „Theoretical and experimental aspects of isotope effects in chemical kinetics.”. Advances in Chemical Physics. 1: 15—76.
- ^ Deegan, Frances M.; Troll, Valentin R.; Whitehouse, Martin J.; Jolis, Ester M.; Freda, Carmela (2016-08-04). „Boron isotope fractionation in magma via crustal carbonate dissolution”. Scientific Reports (на језику: енглески). 6 (1): 30774. Bibcode:2016NatSR...630774D. ISSN 2045-2322. PMC 4973271 . PMID 27488228. doi:10.1038/srep30774.
- ^ Oda Y, Huang K, Cross FR, Cowburn D, Chait BT (јун 1999). „Accurate quantitation of protein expression and site-specific phosphorylation”. Proceedings of the National Academy of Sciences of the United States of America. 96 (12): 6591—6596. Bibcode:1999PNAS...96.6591O. PMC 21959 . PMID 10359756. doi:10.1073/pnas.96.12.6591 .
- ^ Jiang H, English AM (2002). „Quantitative analysis of the yeast proteome by incorporation of isotopically labeled leucine”. Journal of Proteome Research. 1 (4): 345—350. PMID 12645890. doi:10.1021/pr025523f.
- ^ Ong SE, Blagoev B, Kratchmarova I, Kristensen DB, Steen H, Pandey A, Mann M (мај 2002). „Stable isotope labeling by amino acids in cell culture, SILAC, as a simple and accurate approach to expression proteomics”. Molecular & Cellular Proteomics. 1 (5): 376—386. PMID 12118079. doi:10.1074/mcp.M200025-MCP200 .
- ^ Zhu H, Pan S, Gu S, Bradbury EM, Chen X (2002). „Amino acid residue specific stable isotope labeling for quantitative proteomics”. Rapid Communications in Mass Spectrometry. 16 (22): 2115—2123. Bibcode:2002RCMS...16.2115Z. PMID 12415544. doi:10.1002/rcm.831.
- ^ Schoeters F, Van Dijck P (2019). „Protein-Protein Interactions in Candida albicans”. Frontiers in Microbiology. 10: 1792. PMC 6693483 . PMID 31440220. doi:10.3389/fmicb.2019.01792 .
- ^ M.J.T. Milton; R. I. Wielgosz (2000). „Uncertainty in SI-traceable measurements of amount of substance by isotope dilution mass spectrometry”. Metrologia. 37 (3): 199—206. Bibcode:2000Metro..37..199M. S2CID 250890206. doi:10.1088/0026-1394/37/3/3.
- ^ G. V. Hevesy; F. Paneth (1913). „Die Löslichkeit des Bleisulfids und Bleichromats”. Z. Anorg. Allg. Chem. 82 (1): 323—328. doi:10.1002/zaac.19130820125.
- ^ Walker, L.; Wertheim, G.; Jaccarino, V. „Interpretation of the Fe57 Isomer Shift”. Physical Review Letters. 6 (3): 98. Bibcode:1961PhRvL...6...98W. doi:10.1103/PhysRevLett.6.98.
- ^ Nagy, D. L. (1994). „Trends in Mössbauer emission spectroscopy of 57Co/57Fe”. Hyperfine Interactions. 83 (1): 1—19. Bibcode:1994HyInt..83....1N. S2CID 95685404. doi:10.1007/BF02074255.
- ^ Schröder, Christian. „Mössbauer spectroscopy in astrobiology”. Spectroscopy Europe. 27 (2): 10. Архивирано из оригинала 2018-01-08. г. Приступљено 2018-01-08.
- ^ Sarkar, A.; et al. (2007). „Fischer–Tropsch Synthesis: Characterization Rb Promoted Iron Catalyst”. Catalysis Letters. 121 (1–2): 1—11. S2CID 94596943. doi:10.1007/s10562-007-9288-1.
- ^ „Reactors: Modern-Day Alchemy - Argonne's Nuclear Science and Technology Legacy”. www.ne.anl.gov. Приступљено 24. 3. 2021.
- ^ Wellerstein, Alex (2008). „Inside the atomic patent office”. Bulletin of the Atomic Scientists. 64 (2): 26—31. Bibcode:2008BuAtS..64b..26W. ISSN 0096-3402. doi:10.2968/064002008.
- ^ „The Einstein Letter”. Atomicarchive.com. Архивирано из оригинала 2013-06-28. г. Приступљено 2013-06-22.
- ^ а б Yerramilli D, Xu AJ, Gillespie EF, Shepherd AF, Beal K, Gomez D, et al. (2020-07-01). „Palliative Radiation Therapy for Oncologic Emergencies in the Setting of COVID-19: Approaches to Balancing Risks and Benefits”. Advances in Radiation Oncology (на језику: енглески). 5 (4): 589—594. PMC 7194647 . PMID 32363243. doi:10.1016/j.adro.2020.04.001.
- ^ Rades D, Stalpers LJ, Veninga T, Schulte R, Hoskin PJ, Obralic N, et al. (мај 2005). „Evaluation of five radiation schedules and prognostic factors for metastatic spinal cord compression”. Journal of Clinical Oncology. 23 (15): 3366—3375. PMID 15908648. doi:10.1200/JCO.2005.04.754.
- ^ Rades D, Panzner A, Rudat V, Karstens JH, Schild SE (новембар 2011). „Dose escalation of radiotherapy for metastatic spinal cord compression (MSCC) in patients with relatively favorable survival prognosis”. Strahlentherapie und Onkologie. 187 (11): 729—735. PMID 22037654. S2CID 19991034. doi:10.1007/s00066-011-2266-y.
- ^ Rades D, Šegedin B, Conde-Moreno AJ, Garcia R, Perpar A, Metz M, et al. (фебруар 2016). „Radiotherapy With 4 Gy × 5 Versus 3 Gy × 10 for Metastatic Epidural Spinal Cord Compression: Final Results of the SCORE-2 Trial (ARO 2009/01)”. Journal of Clinical Oncology. 34 (6): 597—602. PMID 26729431. doi:10.1200/JCO.2015.64.0862 .
Литература
уреди- Various (2002). Lide, David R., ур. Handbook of Chemistry & Physics (88th изд.). CRC. ISBN 978-0-8493-0486-6. OCLC 179976746. Архивирано из оригинала 2017-07-24. г. Приступљено 2008-05-23.
- Belli, P.; Bernabei, R.; Danevich, F. A.; et al. (2019). „Experimental searches for rare alpha and beta decays”. European Physical Journal A. 55 (8): 140—1—140—7. Bibcode:2019EPJA...55..140B. ISSN 1434-601X. S2CID 201664098. arXiv:1908.11458 . doi:10.1140/epja/i2019-12823-2.
- Various (2002). Lide, David R., ур. Handbook of Chemistry & Physics (88th изд.). CRC. ISBN 978-0-8493-0486-6. OCLC 179976746. Архивирано из оригинала 2017-07-24. г. Приступљено 2008-05-23.
- Kelkar, N. G.; Nowakowski, M. (2016). „Signature of the N = 126 shell closure in dwell times of alpha-particle tunneling”. Journal of Physics G: Nuclear and Particle Physics. 43 (105102). arXiv:1610.02069 . doi:10.1088/0954-3899/43/10/105102.
- Marcillac, Pierre de; Noël Coron; Gérard Dambier; Jacques Leblanc; Jean-Pierre Moalic (2003). „Experimental detection of α-particles from the radioactive decay of natural bismuth”. Nature. 422 (6934): 876—878. Bibcode:2003Natur.422..876D. PMID 12712201. S2CID 4415582. doi:10.1038/nature01541.
- de Carvalho H. G.; de Araújo Penna M. (1972). „Alpha-activity of 209. Bi”. Lett. Nuovo Cimento. 3 (18): 720—722. doi:10.1007/BF02824346.
- Blank, B.; Regan, P.H. (2000). „Magic and doubly-magic nuclei”. Nuclear Physics News. 10 (4): 20—27. S2CID 121966707. doi:10.1080/10506890109411553.
- A. Yu. Smirnov; V. D. Borisevich; A. Sulaberidze (јул 2012). „Evaluation of specific cost of obtainment of lead-208 isotope by gas centrifuges using various raw materials”. Theoretical Foundations of Chemical Engineering. 46 (4): 373—378. S2CID 98821122. doi:10.1134/S0040579512040161.
- Mcclain, D. E.; Miller, A. C.; Kalinich, J. F. (20. 12. 2007). „Status of Health Concerns about Military Use of Depleted Uranium and Surrogate Metals in Armor-Penetrating Munitions” (PDF). NATO. Архивирано из оригинала (PDF) 19. 4. 2011. г. Приступљено 14. 11. 2010.
- Arevalo, Ricardo; McDonough, William F.; Luong, Mario (2009). „The K-U ratio of the silicate Earth: Insights into mantle composition, structure and thermal evolution”. Earth and Planetary Science Letters. 278 (3–4): 361—369. Bibcode:2009E&PSL.278..361A. doi:10.1016/j.epsl.2008.12.023.
- „Radiation and Radioactive Decay. Radioactive Human Body”. Harvard Natural Sciences Lecture Demonstrations. Приступљено 2. 7. 2016.
- Winteringham, F. P. W; Effects, F.A.O. (1989). Radioactive fallout in soils, crops and food: a background review. Standing Committee on Radiation, Land And Water Development Division, Food and Agriculture Organization of the United Nations. Food & Agriculture Org. стр. 32. ISBN 978-92-5-102877-3.
- P. Mohr; F. Kaeppeler; R. Gallino (2007). „Survival of Nature's Rarest Isotope 180Ta under Stellar Conditions”. Phys. Rev. C. 75: 012802. S2CID 44724195. arXiv:astro-ph/0612427 . doi:10.1103/PhysRevC.75.012802.
- Planck Collaboration (2016). „Planck 2015 results. XIII. Cosmological parameters (See Table 4 on page 31 of pfd).”. Astronomy & Astrophysics. 594: A13. Bibcode:2016A&A...594A..13P. S2CID 119262962. arXiv:1502.01589 . doi:10.1051/0004-6361/201525830.
- Dvornický, R.; Šimkovic, F. „Second unique forbidden β decay of 115In and neutrino mass”. AIP Conf. Proc. AIP Conference Proceedings. 1417 (33): 33. Bibcode:2011AIPC.1417...33D. doi:10.1063/1.3671032.
- Bosch, F.; Faestermann, T.; Friese, J.; et al. (1996). „Observation of bound-state β− decay of fully ionized 187Re: 187Re-187Os Cosmochronometry”. Physical Review Letters. 77 (26): 5190—5193. Bibcode:1996PhRvL..77.5190B. PMID 10062738. doi:10.1103/PhysRevLett.77.5190.
- Belli, P.; et al. (2007). „Search for α decay of natural europium”. Nuclear Physics A. 789 (1–4): 15—29. Bibcode:2007NuPhA.789...15B. doi:10.1016/j.nuclphysa.2007.03.001.
- Casali, N.; Nagorny, S. S.; Orio, F.; Pattavina, L.; et al. „Discovery of the 151Eu α decay”. Journal of Physics G: Nuclear and Particle Physics. 41 (7): 075101. Bibcode:2014JPhG...41g5101C. S2CID 116920467. arXiv:1311.2834 . doi:10.1088/0954-3899/41/7/075101.
- Dumé, Belle (2003-04-23). „Bismuth breaks half-life record for alpha decay”. Physicsweb.
Спољашње везе
уреди- Атомске тежине свих изотопа
- The Nuclear Science web portal Nucleonica
- The Karlsruhe Nuclide Chart
- National Nuclear Data Center Portal to large repository of free data and analysis programs from NNDC
- National Isotope Development Center Coordination and management of the production, availability, and distribution of isotopes, and reference information for the isotope community
- Isotope Development & Production for Research and Applications (IDPRA) U.S. Department of Energy program for isotope production and production research and development
- International Atomic Energy Agency Homepage of International Atomic Energy Agency (IAEA), an Agency of the United Nations (UN)
- Atomgewichte, Zerfallsenergien und Halbwertszeiten aller Isotope
- Exploring the Table of the Isotopes at the LBNL
- Current isotope research and information isotope.info
- Emergency Preparedness and Response: Radioactive Isotopes by the CDC (Centers for Disease Control and Prevention)
- Chart of Nuclides Архивирано 2018-10-10 на сајту Wayback Machine Interactive Chart of Nuclides (National Nuclear Data Center)
- Interactive Chart of the nuclides, isotopes and Periodic Table Архивирано 2008-09-30 на сајту Wayback Machine
- The LIVEChart of Nuclides – IAEA with isotope data.
- Annotated bibliography for isotopes from the Alsos Digital Library for Nuclear Issues
- The Valley of Stability (video) – a virtual "flight" through 3D representation of the nuclide chart, by CEA (France)