Natrijum hidrogenkarbonat
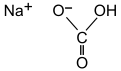
Natrijum hidrogenkarbonat, soda-bikarbona ili natrijum bikarbonat (IUPAC ime: natrijum vodonik karbonat,[14] NaHCO3) je beli prah koji je rastvorljiv u vodi.[15] To je so koju čine natrijumski katjon (Na+) i bikarbonatni anjon (HCO3−). Soda bikarbona je bela čvrsta materija koja je kristalna, ali često se pojavljuje kao fini prah. Ima blago slani, alkalni ukus koji podsjeća na sodu za pranje (natrijum karbonat). Prirodni mineralni oblik je nahkolit. On se sastoji se od minerala natrona i nalazi se rastvoren u mnogim mineralnim izvorima.[16]
| |||
| |||
 | |||
| |||
| Nazivi | |||
|---|---|---|---|
| IUPAC naziv
Natrijum vodonik karbonat
| |||
| Drugi nazivi
Prašak za pecivo, bikarb (laboratorijski sleng), bikarbonatna soda, nahkolit
| |||
| Identifikacija | |||
3D model (Jmol)
|
|||
| Bajlštajn | 4153970 | ||
| ChEBI | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.005.122 | ||
| EC broj | 205-633-8 | ||
| E-brojevi | E500(ii) (regulator kiselosti, ...) | ||
| KEGG[1] | |||
| MeSH | Sodium+bicarbonate | ||
| RTECS | VZ0950000 | ||
| UNII | |||
| |||
| Svojstva | |||
| NaHCO 3 | |||
| Molarna masa | 84,0066 g mol−1 | ||
| Agregatno stanje | Beli kristali | ||
| Miris | bez mirisa | ||
| Gustina |
| ||
| Tačka topljenja | (razlaže se na natrijum karbonat počevši od 50 °C[4][9][10]) | ||
| Rastvorljivost | 0,02 tež.% aceton, 2,13 tež.% metanol @22 °C.[7] nerastvoran u etanolu | ||
| log P | −0,82 | ||
| Kiselost (pKa) | |||
| Indeks refrakcije (nD) | nα = 1,377 nβ = 1,501 nγ = 1,583 | ||
| Struktura | |||
| Kristalna rešetka/struktura | Monoklinična | ||
| Termohemija | |||
| Specifični toplotni kapacitet, C | 87,6 J/mol K[11] | ||
| Standardna molarna entropija S |
101,7 J/mol K[11] | ||
Std entalpija
formiranja (ΔfH⦵298) |
−950,8 kJ/mol[11] | ||
Gibsova slobodna energija (ΔfG˚)
|
−851,0 kJ/mol[11] | ||
| Farmakologija | |||
| B05CB04 (WHO) B05XA02, QG04 | |||
| Načini upotrebe | Intravenozno, oralno | ||
| Opasnosti | |||
| Opasnost u toku rada | Uzrokuje ozbilju iritaciju oka | ||
| NFPA 704 | |||
| Tačka paljenja | ne sagoreva | ||
| Letalna doza ili koncentracija (LD, LC): | |||
LD50 (LD50)
|
4220 mg/kg (pacov, oralno)[12][13] | ||
| Srodna jedinjenja | |||
Drugi anjoni
|
Natrijum karbonat | ||
Drugi katjoni
|
|||
Srodna jedinjenja
|
|||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |||
| Reference infokutije | |||

Pošto je odavno poznata i široko korišćena, ova so ima mnogo različitih imena kao što su soda bikarbona, soda za hleb, soda za kuvanje, soda za vrenje i bikarbont sode, i često se može naći u blizini praška za pecivo[17][18][19] u prodavnicama. Termin baking soda je češći u Sjedinjenim Državama, dok je bicarbonate of soda češći u Australiji, Ujedinjenom Kraljevstvu i Novom Zelandu.[20] Skraćeni kolokvijalni oblici kao što su natrijum bikarb, bikarb soda, bikarbonat i bikarb su uobičajeni.[21]
Prefiks bi- u „bikarbonat” potiče od zastarelog sistema imenovanja koji je prethodio molekularnom znanju. Zasniva se na zapažanju da u natrijum bikarbonatu (NaHCO3) ima dvostruko više karbonata (CO3−2) po natrijumu nego u natrijum karbonatu (Na2CO3).[22] Savremene hemijske formule ovih jedinjenja izražavaju njihov precizan hemijski sastav koji je bio nepoznat kada je skovan naziv bikarbonat potaše (vidi takođe: bikarbonat).
Nomenklatura
уредиS obzirom da je odavno poznata i naširoko se koristi, ova so ima mnoga srodna imena kao što su soda bikarbona, pekarska soda i bikarbonatna soda. Izraz baking soda je češći u Sjedinjenim Državama, dok se naziv bikarbonatna soda češće koristi u Australiji i Britaniji.[23] U kolokvijalnoj upotrebi, nazivi natrijum bikarbonata i sode bikarbone često se skraćuju; forme kao što su natrijum bikarb, bikarb soda, bikarbonat i bikarb su uobičajeni.
Reč saleratus, od latinskog sal æratus (što znači „gazirana so”), bila je u širokoj upotrebi u 19. veku za bikarbonat natrijuma i bikarbonat kalijuma. Ovaj materija je poznat kao jedan od aditiva za hranu, sa E brojem E500.
Prefiks bi u bikarbonatu potiče iz zastarelog sistema imenovanja i zasniva se na zapažanju da postoji dva puta više karbonata (CO3) po natrijumu u natrijum bikarbonatu (NaHCO3) nego u natrijum karbonatu (Na2CO3). Savremene hemijske formule ovih jedinjenja izražavaju njihove precizne hemijske kompozicije (koje su bile nepoznate kada su imena natrijum karbonat i natrijum bikarbonat formirana) kao natrijum hidrogenkarbonat (NaHCO3) i natrijum karbonat (Na2CO3). Ova imena su nedvosmislena, jer natrijum uvek ima +1 oksidaciono stanje i karbonat -2 oksidaciono stanje.
Upotreba
уредиKoristi se u proizvodnji praška za pecivo,[24] u kozmetici, i proizvodnji penušavih pića.
Kuvanje
уредиNarastanje
уредиU pripremi hrane se soda bikarbona prvenstveno koristi pri pečenju kao sredstvo za narastanje peciva. Kada reaguje s kiselinom, oslobađa se ugljen dioksid što uzrokuje širenje testa, i formira se karakteristična tekstura i granulacija u palačinkama, kolačima, brzom hlebu, sodnom hlebu i drugim pečenim i prženim namirnicama. Ova kiselo-bazna reakcija može se generički prikazati na sledeći način:[25]
- NaHCO3 + H+ → Na+ + CO2 + H2O
Kiseli materijali koji izazivaju ovu reakciju uključuju hidrogen fosfate, krem od vinskog kamena, limunov sok, jogurt, neobrano mleko, kakao i sirće. Soda bikarbona se može koristiti zajedno sa kiselim testima, koja su prirodno kisela, čineći proizvod lakšim i sa manje zastupljenim kiselim ukusom.[26]
Toplota takođe može sama po sebi da uzrokuje da bikarbonat deluje kao sredstvo za podizanje pri pečenju zbog termičkog razlaganja, oslobađajući ugljen dioksid na temperaturama iznad 80 °C (180 °F)), na sledeći način:[27]
- 2 NaHCO3 → Na2CO3 + H2O + CO2
Kada se koristi na ovaj način, bez prisustva kiselih sastojaka (bilo u testu ili upotrebom praška za pecivo koji sadrži kiselinu), oslobađa se samo polovina dostupnog CO2 (jedan molekul CO2 se formira na svaka dva ekvivalenta NaHCO3). Pored toga, u nedostatku kiseline, termičkim raspadanjem natrijum bikarbonata nastaje i natrijum karbonat, koji je jako alkalan i daje pečenom proizvodu gorak, „sapunasti” ukus i žutu boju. Pošto se reakcija odvija sporo na sobnoj temperaturi, smeše (testa za kolače itd.) mogu se ostaviti da stoje bez narastanja dok se ne zagreju u rerni.
Kada se dodaje kiselina, alkalni sastojci, kao što su punomasno mleko ili holandski-prerađeni kakao se obično dodaju pečenoj hrani da bi se izbegao prekomerni kiseli ukus dodate kiseline.[28]
Prašak za pecivo
уредиPrašak za pecivo, takođe se prodaje za upotrebu u pripremi hrane u obliku koji sadrži oko 30% bikarbonata i razne kisele sastojke koji se aktiviraju dodavanjem vode, bez potrebe za dodatnim kiselinama u medijumu koji se priprema.[29][30][31] Mnogi oblici praška za pecivo sadrže natrijum bikarbonat u kombinaciji sa kiselim kalcijum fosfatom, natrijum aluminijum fosfatom ili tartarnim kremom.[32] Soda bikarbona je alkalna; kiselina koja se koristi u prašku za pecivo sprečava formiranje metalnog ukusa kada hemijska promena tokom pečenja stvara natrijum-karbonat.
Drugo
уредиSoda bikarbona se ponekad koristila u kuvanju zelenog povrća, jer mu daje jarko zelenu boju - što je opisano kao veštački izgled - zahvaljujući reakciji sa hlorofilom pri čemu nastaje hlorofilin.[33] Međutim, to ima tendenciju da utiče na ukus, teksturu i nutritivni sadržaj i stoga više nije uobičajena praksa.[34]
Prehrambeni aditiv
уредиČesto se koristi u kombinaciji sa drugim aditivima za hranu u flaširanoj vodi radi dodavanja ukusa.[35] Njegov E broj u Evropskoj uniji je E500.[36]
Pirotehnika
уредиNatrijum bikarbonat je jedna od glavnih komponenti uobičajenog vatrometa „crne zmije”.[37][38][39] Efekat je uzrokovan termičkim razlaganjem, koje proizvodi gas ugljen-dioksid da bi se proizveo izdužen pepeo nalik zmiji kao produkt sagorevanja druge glavne komponente, saharoze.[40] Natrijum bikarbonat takođe odlaže reakcije sagorevanja oslobađanjem ugljen-dioksida i vode, od kojih su oba usporivači plamena, kada se zagreju.
Blago dezinfekciono sredstvo
уредиIma slaba dezinfekciona svojstva[41][42] i može biti efikasan fungicid protiv nekih organizama.[43] Pošto će soda bikarbona apsorbovati pljesnive mirise, postala je pouzdan metod za prodavce korišćenih knjiga da učine da knjige imaju manje neprijatan miris.[44]
Aparat za gašenje požara
уредиNatrijum bikarbonat se može koristiti za gašenje plamena na manjim masnoćama ili električnih požara bacanjem preko vatre, jer se zagrevanjem natrijum bikarbonata oslobađa ugljen-dioksid.[24] Međutim, ne treba ga primenjivati na vatri u fritezama, jer iznenadno oslobađanje gasa može izazvati prskanje masti.[24] Natrijum bikarbonat se koristi u suvim hemijskim aparatima za gašenje požara BC kao alternativa korozivnijem monoamonijum fosfatu u ABC aparatima za gašenje požara. Alkalna priroda natrijum bikarbonata čini ga jedinim suvim hemijskim agensom, pored Purple-K,[45][46][47][48] koji se koristio u sistemima za gašenje požara velikih razmera instaliranim u komercijalnim kuhinjama.[49]
Natrijum bikarbonat ima nekoliko mehanizama za gašenje požara koji deluju istovremeno. Kada se zagreje, razlaže se na vodu i ugljen-dioksid, što je endotermna reakcija[50][51][52][53][54][55] koja lišava vatru toplote. Pored toga, on formira intermedijere koji mogu da uklone slobodne radikale koji su odgovorni za širenje vatre.[56] Posebno kod požara masnića,[57][58][59][60][61][62][63][64][65] takođe ima blagi efekat saponifikacije, stvarajući sapunastu penu koja može pomoći u gušenju vatre.[49]
Neutralizacija kiselina
уредиNatrijum bikarbonat spontano reaguje sa kiselinama, oslobađajući gas CO2 kao produkt reakcije. Obično se koristi za neutralizaciju neželjenih rastvora kiselina ili prosutih kiselina u hemijskim laboratorijama.[66] Nije prikladno koristiti natrijum bikarbonat za neutralizaciju baze[67] iako je amfoteran, te reaguje i sa kiselinama i sa bazama.[68]
Sportski suplement
уредиNatrijum bikarbonat se uzima kao sportski suplement za poboljšanje mišićne izdržljivosti.[69] Studije sprovedene uglavnom na muškarcima su pokazale da je natrijum bikarbonat najefikasniji u poboljšanju performansi u kratkotrajnim aktivnostima visokog intenziteta.[70]
Poljoprivreda
уредиNatrijum bikarbonat može sprečiti rast gljivica kada se nanese na lišće, iako neće ubiti gljivice. Prekomerne količine natrijum bikarbonata mogu izazvati promenu boje plodova (dvoprocentni rastvor) i hlorozu (jednopostotni rastvor).[71]
Medicinska upotreba i zdravlje
уредиNatrijum bikarbonat pomešan sa vodom može se koristiti kao antacid za lečenje kiselinskih smetnji i gorušice.[72][73] Njegova reakcija sa želučanom kiselinom proizvodi so, vodu i ugljen-dioksid:
- NaHCO3 + HCl → NaCl + H2O + CO2(g)
Mešavina natrijum bikarbonata i polietilen glikola kao što je PegLajt,[74] rastvorena u vodi i uzimana oralno, je efikasan preparat za ispiranje gastrointestinalnog trakta[75][76][77] i laksativ pre gastrointestinalnih operacija, gastroskopije itd.[78][79][80]
Intravenski natrijum bikarbonat[81][82][83] u vodenom rastvoru se ponekad koristi za slučajeve acidoze,[84][85][86] ili kada je u krvi nedovoljno jona natrijuma ili bikarbonata.[87] U slučajevima respiratorne acidoze, uneti bikarbonatni jon pokreće pufer ugljične kiseline/bikarbonatne plazme ulevo i na taj način podiže pH. Iz tog razloga, natrijum bikarbonat se koristi u kardiopulmonalnoj reanimaciji pod medicinskim nadzorom. Infuzija bikarbonata je indikovana samo kada je pH krvi izrazito nizak (< 7,1–7,0).[88]
HCO3− se koristi za lečenje hiperkalemije, jer će vratiti K+ u ćelije tokom perioda acidoze.[89] Pošto natrijum bikarbonat može izazvati alkalozu, ponekad se koristi za lečenje predoziranja aspirinom. Aspirinu je potrebna kisela sredina za pravilnu apsorpciju, a bazna sredina će smanjiti apsorpciju aspirina u slučajevima predoziranja.[90] Natrijum bikarbonat je takođe korišćen u lečenju predoziranja tricikličnim antidepresivima.[91] Takođe se može primeniti lokalno kao pasta, sa tri dela sode bikarbone na jedan deo vode, za ublažavanje nekih vrsta ujeda i uboda insekata (kao i pratećih otoka).[92]
Neki alternativni praktičari, kao što je Tulio Simončini, promovisali su sodu bikarbonu kao lek protiv raka, na šta je Američko udruženje za borbu protiv raka upozorilo zbog njene nedokazane efikasnosti i potencijalne opasnosti u upotrebi.[93] Edzard Ernst je promociju natrijum bikarbonata kao leka protiv raka nazvao „jednom od najodvratnijih alternativnih prevara protiv raka koje sam video već duže vreme”.[94]
Natrijum bikarbonat se može dodati lokalnim anesteticima, da bi se ubrzao početak njihovog dejstva i da bi njihova injekcija bila manje bolna.[95] Takođe je komponenta Mofetovog rastvora, koji se koristi u hirurgiji nosa.[96]
Predloženo je da kisela dijeta oslabljuje kosti.[97] Jedna sistematska metaanaliza istraživanja nije pokazala takav efekat.[98] Jedna druga takođe smatra da nema dokaza da alkalna ishrana poboljšava zdravlje kostiju, ali sugeriše da alkalna ishrana „možda ima neku vrednost“ iz drugih razloga.[99]
Rastvori antacida (kao što je soda bikarbona) su pripremljeni i korišćeni od strane demonstranata da ublaže efekte izlaganja suzavcu tokom protesta.[100]
Slično njegovoj upotrebi u pečenju, natrijum bikarbonat se koristi zajedno sa blagom kiselinom kao što je vinska kiselina kao ekscipijent u šumećim tabletama: kada se takva tableta ispusti u čašu vode, karbonat napušta reakcioni medijum kao gas ugljen-dioksid (HCO3− + H+ → H2O + CO2↑ ili, tačnije, HCO3− + H3O+ → 2 H2O + CO2↑). Ovo čini da se tableta raspadne, ostavljajući lek suspendovan i/ili rastvoren u vodi zajedno sa rezultujućom solju (u ovom primeru, natrijum tartarat).[101]
Lična higijena
уредиNatrijum bikarbonat se takođe koristi kao sastojak u nekim sredstvima za ispiranje usta. Ima antikarijesna i abrazivna svojstva.[102] Deluje kao mehaničko sredstvo za čišćenje zuba i desni, neutrališe proizvodnju kiseline u ustima, a deluje i kao antiseptik kako bi se sprečile infekcije.[103][104] Natrijum bikarbonat u kombinaciji sa drugim sastojcima može se koristiti za pravljenje suvog ili vlažnog dezodoransa.[105][106] Natrijum bikarbonat se može koristiti kao pufersko sredstvo, u kombinaciji sa kuhinjskom solju, kada se pravi rastvor za ispiranje nosa.[107]
Koristi se u higijeni očiju za lečenje blefaritisa. Ovo se postiže dodavanjem kašičice natrijum bikarbonata u hladnu vodu koja je nedavno prokuvana, a zatim sledi nežno ribanje baze trepavica pamučnim štapićem umočenim u rastvor.[108][109]
Veterinarska upotreba
уредиNatrijum bikarbonat se koristi kao dodatak hrani za stoku, posebno kao pufersko sredstvo za burag.[110]
Sredstvo za čišćenje
уредиNatrijum bikarbonat se koristi u procesu uklanjanja boje i korozije koji se zove peskarenje sodom.[111][112] Kao medijum za peskarenje, natrijum bikarbonat se koristi za uklanjanje površinske kontaminacije sa mekših i manje otpornih podloga kao što su aluminijum, bakar ili drvo koje bi mogle da budu oštećene abrazivnim medijumom silicijumskog peska.[113]
Proizvođač preporučuje pastu napravljenu od sode bikarbone sa minimalnom količinom vode kao blagi prašak za ribanje.[24] Takva pasta može biti korisna u uklanjanju površinske rđe jer rđa formira jedinjenje rastvorljivo u vodi kada se nalazi u koncentrovanom alkalnom rastvoru.[114] Treba koristiti hladnu vodu jer rastvori tople vode mogu korodirati čelik.[115] Natrijum bikarbonat napada tanak zaštitni sloj oksida koji se formira na aluminijumu, čineći ga nepogodnim za čišćenje ovog metala.[116] Rastvor u toploj vodi će ukloniti mrlje sa srebra kada je srebro u kontaktu sa komadom aluminijumske folije.[116][117] Soda bikarbona se obično dodaje u mašine za pranje veša kao zamena za omekšivač vode i za uklanjanje mirisa iz odeće. Kada se razblaži toplom vodom, takođe je skoro jednako efikasan u uklanjanju teških mrlja od čaja i kafe sa šoljica kao natrijum hidroksid.
Tokom Menhetn projekta za razvoj nuklearne bombe početkom 1940-ih, hemijska toksičnost uranijuma bila je problem. Utvrđeno je da se oksidi uranijuma veoma dobro lepe za pamučnu tkaninu i da se ne ispiraju sapunom ili deterdžentom za veš. Međutim, uranijum bi se isprao sa 2% rastvora natrijum bikarbonata. Odeća se može kontaminirati toksičnom prašinom osiromašenog uranijuma (DU), koja je veoma gusta, te se koristi za protivtegove u civilnom kontekstu i u projektilima za probijanje oklopa. DU se ne uklanja normalnim pranjem; pranje sa oko 6 oz (170 g) sode bikarbone u 2 galona (7,5 L) vode pomaže da se ispere.[118]
Kontrola mirisa
уредиČesto se tvrdi da je soda bikarbona efikasno sredstvo za uklanjanje mirisa[119] i preporučuje se da se otvorena kutija drži u frižideru kako bi apsorbovala miris.[120] Ovu ideju promovisao je vodeći američki brend sode bikarbone, Arm & Hammer, u reklamnoj kampanji koja je počela 1972. godine.[121] Iako se ova kampanja smatra klasikom marketinga, koja je u roku od godinu dana dovela do toga da više od polovine američkih frižidera sadrži kutiju sode bikarbone,[122][123] malo je dokaza da je efikasna u ovoj primeni.[124][125]
Hemijske osobine
уредиRastvor natrijum bikarbonata reaguje slabo bazno zbog hidrolize. To je jedan od aditiva kodiran od strane Evropske unije, identifikovan inicijalima E500. Rastvoren u vodi daje baznu sredinu. Reaguje sa kiselinama i tako razblažen, oslobađa vodu i ugljen-dioksid.
Zbog svoje sposobnosti da reaguje sa kiselinama, koristi se i u farmaceutskoj industriji kao antacid i protiv gorušice. Prekomernu upotrebu treba izbegavati, jer utiče na pH vrednost želuca. Višak natrijuma povećava krvni pritisak (povećava rizik od hipertenzije i edema).
Natrijum bikarbonat je amfoterno jedinjenje.[68]] Vodeni rastvori su blago alkalni zbog stvaranja ugljene kiseline i hidroksid jona:[68]
- HCO−
3 + H2O → H
2CO
3 + OH−
Natrijum bikarbonat se ponekad može koristiti kao blagi agens za neutralizaciju i sigurnija alternativa jakim bazama kao što je natrijum hidroksid.[126] Reakcija natrijum bikarbonata i kiseline proizvodi so i ugljenu kiselinu, koja se lako razlaže na ugljen-dioksid i vodu:[126]
- NaHCO3 + HCl → NaCl + H2O+CO2
- H2CO3 → H2O + CO2(g)
Natrijum bikarbonat reaguje sa sirćetnom kiselinom (koja se nalazi u sirćetu), stvarajući natrijum acetat, vodu i ugljen-dioksid:
- NaHCO3 + CH3COOH → CH3COONa + H2O + CO2(g)
Natrijum bikarbonat reaguje sa bazama kao što je natrijum hidroksid da bi se formirali karbonati:
- NaHCO3 + NaOH → Na2CO3 + H2O
Termičko raspadanje
уредиNa temperaturama od 80–100 °C (176–212 °F), natrijum bikarbonat se postepeno razlaže na natrijum karbonat, vodu i ugljen-dioksid. Konverzija je brža na 200 °C (392 °F):[127]
- 2 NaHCO3 → Na2CO3 + H2O + CO2
Većina bikarbonata prolazi kroz ovu reakciju dehidracije. Dalje zagrevanje pretvara karbonat u oksid (iznad 850 °C/1.560 °F):[127]
- Na2CO3 → Na2O + CO2
Generisanje ugljen-dioksida i vode delimično objašnjava svojstva gašenje požara NaHCO3,[49] iako su drugi faktori kao što su apsorpcija toplote i uklanjanje radikala značajniji.[56]
Prirodna pojava
уредиU prirodi, natrijum bikarbonat se javlja skoro isključivo kao nahkolit[128] ili trona.[129][130][131][132][133] Trona je češća, jer je nakolit rastvorljiviji u vodi i hemijska ravnoteža između dva minerala favorizuje tronu.[16] Značajna nalazišta nahkolita nalaze se u Sjedinjenim Državama, Bocvani i Keniji, Ugandi, Turskoj i Meksiku.[134] Najveća nalazišta trone su u basenu Grin reke u Vajomingu.[135]
Nahkolit se ponekad nalazi kao komponenta uljnih škriljaca.[136]
Stabilnost i rok trajanja
уредиAko se drži na hladnom (sobna temperatura) i suvom (preporučuje se hermetički zatvorena posuda da bi se sprečio pristup vlažnog vazduha), natrijum bikarbonat se može čuvati bez značajne količine raspadanja najmanje dve ili tri godine.[137][138][139][140]
Istorija
уредиReč natron je bila u upotrebi u mnogim jezicima tokom modernog vremena (u oblicima anatron, natrum i natron) i nastala je (poput španskog, francuskog i engleskog natron, kao i 'natrijum') preko arapskog naṭrūn (ili anatrūn; up. donjeegipatski „Natrontal“ Vadi El Natrun, gde je korišćena mešavina natrijum karbonata i natrijum hidrogenkarbonata za dehidraciju mumija[141]) iz grčkog nítron (νίτρον) (Herodot; atički lítron (λίτρον)), koji se može prati do staroegipatskog ntr. Grčki nítron (soda, šalitra) se takođe koristio u latinskom (sal) nitrum i u nemačkom Salniter (izvor azota, nitrat itd).[142][143] Reč saleratus, od latinskog sal æratus (što znači „gazirana so”), bila je naširoko korišćena u 19. veku i za natrijum bikarbonat i za kalijum bikarbonat.[144]
Godine 1791, francuski hemičar Nikola Lebla proizveo je natrijum karbonat (poznat i kao soda pepeo). Apotekar Valentin Rouz mlađi je zaslužan za otkriće natrijum bikarbonata 1801. godine u Berlinu. Godine 1846, dva američka pekara, Džon Dvajt i Ostin Čerč, osnovali su prvu fabriku u Sjedinjenim Državama za proizvodnju sode bikarbone od natrijum karbonata i ugljen-dioksida.[145]
Saleratus, kalijum ili natrijum bikarbonat, pominje se u romanu Kapetani hrabri pisca Radjarda Kipliga kao široko korišćen u 1800-im godinama u komercijalnom ribolovu kako bi se sprečilo kvarenje sveže ulovljene ribe.[146]
Godine 1919, američki senator Li Overman je izjavio da soda bikarbona može da izleči španski grip. U jeku rasprave 26. januara 1919. prekinuo je diskusiju da bi najavio otkriće leka. „Želim da kažem, za dobrobit onih koji vode ovu istragu“, izvestio je on, „da mi je sudija višeg suda u planinskoj državi Severne Karoline rekao da su otkrili lek za ovu bolest.” Navodni lek je podrazumevao kritiku moderne nauke i uvažavanje jednostavne mudrosti jednostavnih ljudi. „Kažu da će obična soda bikarbona izlečiti bolest“, nastavio je, „da su je izlečili njome, da tamo gore uopšte nema smrti; koriste običnu sodu bikarbonu, koja leči bolest.“[147]
Proizvodnja
уредиNatrijum bikarbonat se industrijski proizvodi od natrijum karbonata:[148]
- Na2CO3 + CO2 + H2O → 2 NaHCO3
Proizvodi se u razmerama od oko 100.000 tona godišnje (od 2001. godine)[149] sa proizvodnim kapacitetom širom sveta od 2,4 miliona tona godišnje (od 2002. godine).[150] Komercijalne količine sode bikarbone takođe se proizvode sličnim metodom: soda pepeo, iskopana u obliku rude trona, rastvara se u vodi i tretira ugljen-dioksidom. Natrijum bikarbonat se taloži kao čvrsta supstanca iz ovog rastvora.
U Solvejevom procesu, natrijum bikarbonat je intermedijer u reakciji natrijum hlorida, amonijaka i ugljen-dioksida. Proizvod međutim pokazuje nisku čistoću (75 %).
Iako nema praktičnu vrednost, NaHCO3 se može dobiti reakcijom ugljen-dioksida sa vodenim rastvorom natrijum hidroksida:
- CO2 + NaOH → NaHCO3
Rudarstvo
уредиPrirodne naslage nahkolita (NaHCO3) nalaze se u formaciji Zelene reke iz eocenskog doba (pre 55,8–33,9 miliona godina), u basenu Pijans u Koloradu. Nahkolit je deponovan kao ležišta tokom perioda visokog isparavanja u basenu. Komercijalno se kopa korišćenjem uobičajenih tehnika podzemnog rudarstva, kao što su bušenje, bubanj i iskopavanje dugih zidova na način koji je veoma sličan kopanju uglja.
Takođe se proizvodi iskopavanjem rastvora, pumpanjem zagrejane vode kroz slojeve nahkolita i kristalizacijom rastvorenog nahkolita kroz proces kristalizacije hlađenjem.
Pošto se nahkolit ponekad nalazi u škriljcima, može se proizvesti kao koproizvod ekstrakcije nafte iz škriljaca, gde se dobija iz rastvora.[136]
U popularnoj kulturi
уредиNatrijum bikarbonat, kao „soda bikarbona”, bio je čest izvor fraza za Gruča Marksa u filmovima braće Marks. U Pačjoj supi, Marks igra vođu nacije u ratu. U jednoj sceni dobija poruku sa bojnog polja da njegov general prijavljuje gasni napad, a Gručo kaže svom pomoćniku: „Reci mu da uzme kašičicu sode bikarbone i po čašu vode.“[151] Noć u operi, Gručov lik se obraća publici prve večeri u operi govoreći o glavnom tenoru: „Signor Laspari potiče iz veoma poznate porodice. Njegova majka je bila poznata bas pevačica. Njegov otac je bio prvi čovek koji je napunio špagete sodom bikarbonom, izazivajući i lečeći probavne smetnje u isto vreme.“[152]
U klasiku Džozefa L. Mankeviča Sve o Evi, lik Maksa Fabijana (Gregori Ratof) ima proširenu scenu sa Margo Čening (Bet Dejvis) u kojoj, pati od žgaravice, traži, a zatim pije sodu bikarbonu, izazivajući izraženo podrigivanje. Čening obećava da će uvek držati kutiju bikarba sa Maksovim imenom na njoj.
Vidi još
уредиReference
уреди- ^ Joanne Wixon; Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast. 17 (1): 48—55. doi:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б Haynes, p. 4.90
- ^ а б в Haynes, p. 5.194
- ^ а б в „Sodium Bicarbonate” (PDF). United Nations Environment Programme. Архивирано из оригинала (PDF) 16. 5. 2011. г.
- ^ Ellingboe JL, Runnels JH (1966). „Solubilities of Sodium Carbonate and Sodium Bicarbonate in Acetone-Water and Methanol-Water Mixtures”. Journal of Chemical & Engineering Data. 11 (3): 323—324. doi:10.1021/je60030a009.
- ^ а б Haynes, p. 7.23
- ^ Pasquali I, Bettini R, Giordano F (2007). „Thermal behaviour of diclofenac, diclofenac sodium and sodium bicarbonate compositions”. Journal of Thermal Analysis and Calorimetry. 90 (3): 903—907. doi:10.1007/s10973-006-8182-1.
- ^ „Decomposition of Carbonates”. General Chemistry Online. Архивирано из оригинала 2. 10. 1999. г. Приступљено 28. 6. 2010.
- ^ а б в г Haynes, p. 5.19
- ^ Chambers M. „Sodium bicarbonate [USP:JAN]”. ChemIDplus. U.S. National Library of Medicine.
- ^ Griffith, John F. (1964). „Interlaboratory variations in the determination of acute oral LD50”. Toxicology and Applied Pharmacology. 6 (6): 726—730. PMID 14235840. doi:10.1016/0041-008X(64)90124-3.
- ^ Nomenclature of Inorganic Chemistry IUPAC Recommendations 2005 (PDF), IUPAC, стр. 137, Архивирано (PDF) из оригинала 2017-05-18. г.
- ^ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego. 2001. ISBN 978-0-12-352651-9.
- ^ а б Gärtner, Robert S.; Witkamp, Geert-Jan (август 2007). „Mixed solvent reactive recrystallization of trona (sodium sesqui-carbonate) into soda (sodium carbonate anhydrate)”. Hydrometallurgy (на језику: енглески). 88 (1–4): 75—91. Bibcode:2007HydMe..88...75G. doi:10.1016/j.hydromet.2007.03.006.
- ^ Matz, Samuel A. (1992). Bakery Technology and Engineering (3 изд.). Springer. стр. 54. ISBN 9780442308551. Приступљено 2009-08-12.
- ^ McGee, Harold (2004). On Food and Cooking (revised изд.). Scribner-Simon & Schuster. стр. 533. ISBN 9781416556374. Приступљено 2009-08-12.
- ^ Reisert, Sarah (2018). „Baking up a Storm: When crime and politics influenced American baking habits”. Distillations. 4 (3): 46—47. Приступљено 23. 8. 2018.
- ^ „Baking powder, baking soda or bicarbonate of soda?”. Reader's Digest Australia (на језику: енглески). Приступљено 2024-06-02.
- ^ PubChem. „Sodium bicarbonate”. pubchem.ncbi.nlm.nih.gov (на језику: енглески). Приступљено 2021-01-25.
- ^ Wollaston, WH (јануар 1814). „I. A Synoptic scale of chemical equivalents”. Philosophical Transactions of the Royal Society of London. 104: 1—22. S2CID 96774986. doi:10.1098/rstl.1814.0001.
- ^ „What's the difference between bicarbonate of soda, baking soda and baking powder?”. ThatsLife! Pacific Network.
- ^ а б в г „Arm & Hammer Baking Soda - Basics - The Magic Of Arm & Hammer Baking Soda”. Armhammer.com. Архивирано из оригинала 31. 8. 2009. г. Приступљено 30. 7. 2009.
- ^ Bent AJ, ур. (1997). The Technology of Cake Making (6 изд.). Springer. стр. 102. ISBN 9780751403497. Приступљено 12. 8. 2009.
- ^ Cascio J. „Sourdough” (PDF). University of Alaska Fairbanks Cooperative Extension Service. FNH-00061. Архивирано из оригинала (PDF) 27. 3. 2016. г. Приступљено 2. 5. 2017.
- ^ „The Many Practical Uses of Baking Soda in the Kitchen”. About.com Food. Архивирано из оригинала 02. 02. 2017. г. Приступљено 22. 1. 2017. „In a nutshell, the uses for baking soda are many: It deodorizes, neutralizes, and cleans all without the toxic mess of most commercial products.”
- ^ „Baking 101: The Difference Between Baking Soda and Baking Powder”. Joy the Baker. Приступљено 4. 8. 2015.
- ^ Czernohorsky JH, Hooker R. „The Chemistry of Baking” (PDF). New Zealand Institute of Chemistry. Архивирано из оригинала (PDF) 27. 11. 2016. г. Приступљено 22. 1. 2017.
- ^ „Baking Soda and Baking Powder”. FineCooking.com (на језику: енглески). Архивирано из оригинала 02. 02. 2017. г. Приступљено 22. 1. 2017.
- ^ „Baking Soda FAQs”. Arm & Hammer Multi-Brand. Church & Dwight Company. What is the difference baking soda and baking powder?. Архивирано из оригинала 27. 6. 2017. г. Приступљено 20. 7. 2017.
- ^ „Glossary Ingredients”. Cooking.com. Архивирано из оригинала 12. 7. 2013. г. Приступљено 31. 5. 2020.
- ^ Srilakshmi B (2003). Food Science. New Age International. стр. 188. ISBN 978-81-224-1481-3.
- ^ Sukhadwala S. „Bicarbonate of soda recipes”. BBC Food. Приступљено 20. 7. 2017.
- ^ Stanek, Becca (24. 7. 2014). „Why Your Bottled Water Contains Four Different Ingredients”. TIME.
- ^ „Approved additives and E numbers”. Food Standards Agency (на језику: енглески). Приступљено 7. 12. 2020.
- ^ Helmenstine, Anne Marie (3. 6. 2020). „How to Make Black Snake or Glow Worms”. Архивирано из оригинала 14. 10. 2019. г. Приступљено 16. 10. 2019.
- ^ Helmenstine, Anne Marie (3. 6. 2020). „How to Make a Pharaoh's Snake Firework”. Архивирано из оригинала 17. 10. 2019. г. Приступљено 16. 10. 2019.
- ^ Davis, T. L. (1940). „Pyrotechnic Snakes”. Journal of Chemical Education. 17 (6): 268—270. doi:10.1021/ed017p268.
- ^ „Sugar snake”. MEL Science. MEL Science 2015–2019. Архивирано из оригинала 6. 10. 2019. г. Приступљено 28. 10. 2019.
- ^ Malik YS, Goyal SM (мај 2006). „Virucidal efficacy of sodium bicarbonate on a food contact surface against feline calicivirus, a norovirus surrogate”. International Journal of Food Microbiology. 109 (1–2): 160—3. PMID 16540196. doi:10.1016/j.ijfoodmicro.2005.08.033.
- ^ Rutala WA, Barbee SL, Aguiar NC, Sobsey MD, Weber DJ (јануар 2000). „Antimicrobial activity of home disinfectants and natural products against potential human pathogens”. Infection Control and Hospital Epidemiology. 21 (1): 33—8. PMID 10656352. S2CID 34461187. doi:10.1086/501694.
- ^ Zamani M, Sharifi Tehrani A, Ali Abadi AA (2007). „Evaluation of antifungal activity of carbonate and bicarbonate salts alone or in combination with biocontrol agents in control of citrus green mold”. Communications in Agricultural and Applied Biological Sciences. 72 (4): 773—7. PMID 18396809.
- ^ Altman, Gail (22. 5. 2006). „Book Repair for BookThinkers: How To Remove Odors From Books”. The BookThinker (69).
- ^ Glenn Corbett (ed.), Fire Engineering's Handbook for Firefighter I and II Penn Well 2009, ISBN 1593701357 page 98
- ^ Dry Chemical Agents- Purple-K in Chemguard
- ^ "Purple K Powder", "Naval Aviation News", September 1959, page 19
- ^ Fire extinguishing powders. A. E. Finnerty US. Army Research Laboratory, L. J. Vande Kieft. Halon Options. Technlcal Working Conference 6-8 May 1997. [1]
- ^ а б в Voelkert, J. Craig (2015). „Fire and Fire Extinguishment - A Brief Guide to Fire Chemistry and Extinguishment Theory for fire Equipment Service Technicians” (PDF). стр. 14—15. Архивирано из оригинала (PDF) 2024-05-31. г. Приступљено 22. 9. 2023.
- ^ „17.3: Exothermic and Endothermic Processes”. Chemistry LibreTexts (на језику: енглески). 2016-06-27. Приступљено 2024-06-26.
- ^ Oxtoby, D. W; Gillis, H.P., Butler, L. J. Principle of Modern Chemistry. 2015., Brooks Cole. p. 617. ISBN 978-1305079113
- ^ Sutton, Mike (2007-03-01). „Chemistry for the common good”. Chemistry World (на језику: енглески). Приступљено 2024-06-26.
- ^ „endothermic | Etymology of endothermic by etymonline”. www.etymonline.com (на језику: енглески). Приступљено 2024-06-28.
- ^ Lu, Jue Xi; Tupper, Connor; Gutierrez, Alejandra V.; Murray, John (2024), „Biochemistry, Dissolution and Solubility”, StatPearls, Treasure Island (FL): StatPearls Publishing, PMID 28613752, Приступљено 2024-06-28
- ^ „Endothermic & Exothermic Reactions” (PDF). Ashrae. Приступљено 2024-06-28.
- ^ а б Liu, Yang; Zhang, Yansong; Meng, Xiangbao; Yan, Ke; Wang, Zheng; Liu, Jiqing; Wang, Zhifeng; Yang, Panpan; Dai, Wenjiao; Li, Fang (април 2022). „Research on flame propagation and explosion overpressure of oil shale dust explosion suppression by NaHCO3”. Fuel (на језику: енглески). 314: 122778. Bibcode:2022Fuel..31422778L. doi:10.1016/j.fuel.2021.122778.
- ^ NFPA's Illustrated Dictionary of Fire Service Terms, p. 23 (National Fire Protection Association/Jones and Bartlett Publishers: 2006).
- ^ James R. Gillespie & Frank Flanders, Modern Livestock & Poultry Production, 8th ed. (Centgage Learning: 2009), p. 76.
- ^ International Association of Fire Chiefs / National Fire Protection Association, Fire Inspector: Principles and Practice (Jones and Bartlett Publishers, 2012), pp. 204-06.
- ^ Robert H. Hill, Jr. & David C. Finster, Laboratory Safety for Chemistry Students (2d ed.: John Wiley & Sons, 2016).
- ^ JB Crippin, "Types of Fires" in Forensic Chemistry (ed. Max M. Houck: Academic Press, 2015), p. 219.
- ^ API (1991). Fighting Fires in and Around Flammable and Combustible Liquid Atmospheric Storage Tanks. API Publication 2021 (3rd изд.). Washington, D.C.: American Petroleum Institute. стр. 29.
- ^ NFPA (2018). Flammable and Combustible Liquids Code. NFPA 30 (2018 изд.). Quincy, Mass.: National Fire Protection Association. стр. 102. ISBN 978-145591661-0.
- ^ Lon H. Ferguson & Christopher A. Janicak, Fundamentals of Fire Protection for the Safety Professional. (2d ed. 2015), pp. 203-04.
- ^ Schubert, Warren; Ahrenholz, David H.; Solem, Lynn D. (1990). „Burns from Hot Oil and Grease: A Public Health Hazard”. Journal of Burn Care & Rehabilitation. 11 (6): 558—62. PMID 2286612. doi:10.1097/00004630-199011000-00014.
- ^ „Prepare for Emergencies from Uncontrolled Hazards”. American Chemical Society.
- ^ Hurum, Deanna. „Laboratory Safety” (PDF). Civil Engineering. Northwestern University.
- ^ а б в Davidson, David (новембар 1955). „Amphoteric molecules, ions and salts”. Journal of Chemical Education (на језику: енглески). 32 (11): 550. Bibcode:1955JChEd..32..550D. ISSN 0021-9584. doi:10.1021/ed032p550.
- ^ Grgic J, Rodriguez RF, Garofolini A, Saunders B, Bishop DJ, Schoenfeld BJ, Pedisic Z (2020). „Effects of Sodium Bicarbonate Supplementation on Muscular Strength and Endurance: A Systematic Review and Meta-analysis”. Sports Medicine. 50 (7): 1361—1375. PMID 32096113. S2CID 211254185. doi:10.1007/s40279-020-01275-y.
- ^ Grgic J, Grgic I, Pedisic Z (2021). „Effects of sodium bicarbonate supplementation on exercise performance: an umbrella review”. Journal of the International Society of Sports Nutrition. 18 (1): 71. PMC 8600864 . PMID 34794476. doi:10.1186/s12970-021-00469-7 .
- ^ „Horticulture myths”. University of Vermont Extension Department of Plant and Soil Science. Архивирано из оригинала 7. 8. 2019. г. Приступљено 18. 10. 2021.
- ^ „Sodium Bicarbonate”. Jackson Siegelbaum Gastroenterology. 1998. Архивирано из оригинала 5. 10. 2016. г. Приступљено 4. 10. 2016.
- ^ „Sodium Bicarbonate (Oral Route, Intravenous Route, Subcutaneous Route) Side Effects - Mayo Clinic”. www.mayoclinic.org. Приступљено 2023-05-05.
- ^ „PegLyte”. Pendo Phama.
- ^ „Latest British Extracts”. Sydney Gazette and New South Wales Advertiser. 17. 2. 1825.
- ^ Gary R. Fleisher; Stephen Ludwig; Benjamin K. Silverman (2002). Synopsis of pediatric emergency medicine. Lippincott Williams & Wilkins. стр. 409—. ISBN 978-0-7817-3274-1. Приступљено 4. 8. 2010.
- ^ Laura W Kates; Erik D Schraga (12. 12. 2008). „Cooling Techniques for Hyperthermia: Treatment & Medication”. eMedicine. Omaha, Nebraska, USA: Medscape. стр. 2. Приступљено 3. 11. 2010.
- ^ „Gastroscopy – examination of oesophagus and stomach by endoscope”. BUPA. децембар 2006. Архивирано из оригинала 2007-10-06. г. Приступљено 2007-10-07.
- ^ National Digestive Diseases Information Clearinghouse (новембар 2004). „Upper Endoscopy”. National Institutes of Health. Приступљено 2007-10-07.
- ^ „What is Upper GI Endoscopy?”. Patient Center -- Procedures. American Gastroenterological Association. Архивирано из оригинала 2007-09-28. г. Приступљено 2007-10-07.
- ^ World Health Organization (2009). Stuart MC, Kouimtzi M, Hill SR, ур. WHO Model Formulary 2008. World Health Organization. стр. 489–492. ISBN 9789241547659. hdl:10665/44053.
- ^ Bruccoleri RE, Burns MM (март 2016). „A Literature Review of the Use of Sodium Bicarbonate for the Treatment of QRS Widening”. Journal of Medical Toxicology. 12 (1): 121—129. PMC 4781799 . PMID 26159649. doi:10.1007/s13181-015-0483-y.
- ^ British National Formulary: BNF 69 (69th изд.). British Medical Association. 2015. стр. 684. ISBN 9780857111562.
- ^ Yee AH, Rabinstein AA (фебруар 2010). „Neurologic presentations of acid-base imbalance, electrolyte abnormalities, and endocrine emergencies”. Neurol Clin. 28 (1): 1—16. PMID 19932372. doi:10.1016/j.ncl.2009.09.002.
- ^ „MedlinePlus Medical Encyclopedia: Respiratory acidosis”. Архивирано из оригинала 11. 12. 2008. г. Приступљено 2008-12-06.
- ^ „eMedicine - Respiratory Acidosis : Article by Jackie A Hayes”. Архивирано из оригинала 29. 10. 2008. г. Приступљено 2008-12-06.
- ^ „Sodium Bicarbonate Intravenous Infusion” (PDF). Consumer Medicine Information. Better Health Channel. 13. 7. 2004. Архивирано из оригинала (PDF) 22. 8. 2008. г.
- ^ „Respiratory Acidosis: Treatment & Medication”. emedicine. 26. 3. 2020.
- ^ Dart, Richard C. (2004). Medical Toxicology. Lippincott Williams & Wilkins. стр. 910—. ISBN 978-0-7817-2845-4.
- ^ Cloth Diapers. Donald C. Cooper PhD. стр. 46—.
- ^ Knudsen K, Abrahamsson J (април 1997). „Epinephrine and sodium bicarbonate independently and additively increase survival in experimental amitriptyline poisoning”. Critical Care Medicine. 25 (4): 669—74. PMID 9142034. doi:10.1097/00003246-199704000-00019.
- ^ „Insect bites and stings: First aid”. Mayo Clinic. 15. 1. 2008.
- ^ „Sodium Bicarbonate”. American Cancer Society. 28. 11. 2008. Архивирано из оригинала 19. 2. 2013. г. Приступљено 19. 2. 2013.
- ^ Ernst, Edzard (3. 2. 2017). „This must be the most sickening cancer scam I have seen for a while”.
- ^ Edgcombe, H; Hocking, G (6. 10. 2006). „Local Anaesthetic Pharmacology”. Anaesthesia UK. Архивирано из оригинала 22. 12. 2015. г.
- ^ Benjamin, E.; Wong, D.K.K.; Choa, D. (2004). „'Moffett's' solution: a review of the evidence and scientific basis for the topical preparation of the nose”. Clinical Otolaryngology and Allied Sciences. 29 (6): 582—587. PMID 15533141. doi:10.1111/j.1365-2273.2004.00894.x .
- ^ Fox, Douglas (15. 12. 2001). „Hard cheese”. New Scientist. Приступљено 20. 7. 2017.
- ^ Fenton, T. R.; Tough, S. C.; Lyon, A. W.; Eliasziw, M.; Hanley, D. A. (2011). „Causal assessment of dietary acid load and bone disease: A systematic review & meta-analysis applying Hill's epidemiologic criteria for causality”. Nutrition Journal. 10: 41. PMC 3114717 . PMID 21529374. doi:10.1186/1475-2891-10-41 .
- ^ Schwalfenberg, Gerry K. (2012). „The Alkaline Diet: Is There Evidence That an Alkaline pH Diet Benefits Health?”. Journal of Environmental and Public Health. 2012: 1—7. PMC 3195546 . PMID 22013455. doi:10.1155/2012/727630 .
- ^ „Medical information from Prague 2000”. Архивирано из оригинала 18. 10. 2014. г.
- ^ Shirsand, S. B.; Suresh, Sarasija; Jodhana, L. S.; Swamy, P. V. (2010). „Formulation Design and Optimization of Fast Disintegrating Lorazepam Tablets by Effervescent Method”. Indian Journal of Pharmaceutical Sciences. 72 (4): 431—436. ISSN 0250-474X. PMC 3013557 . PMID 21218052. doi:10.4103/0250-474X.73911 .
- ^ Storehagen, Silje; Ose, Nanna; Midha, Shilpi. „Dentifrices and mouthwashes ingredients and their use” (PDF). Institutt for klinisk odontologi. Universitetet i Oslo.
- ^ US 4132770A, Barth J, "Oral Product", issued 1979
- ^ Iqbal K, Asmat M, Jawed S, Mushtaque A, Mohsin F, Hanif S, et al. (јул 2011). „Role of different ingredients of tooth pastes and mouthwashes in oral health.” (PDF). Journal of Pakistan Dental Association. 20 (3): 163—70.
- ^ Lamb, John Henderson (1946). „Sodium Bicarbonate: An Excellent Deodorant”. The Journal of Investigative Dermatology. 7 (3): 131—133. doi:10.1038/jid.1946.13 .
- ^ „Bicarb soda: natural body deodorant”. sustainableecho.com. 10. 3. 2009.
- ^ Metson, Ralph B. (2005). The Harvard Medical School Guide to Healing Your Sinues. McGraw Hill. стр. 68. ISBN 9780071444699.
- ^ „Blepharitis : Information for patients leaflet” (PDF). Ouh.nhs.uk. Приступљено 28. 2. 2022.
- ^ „Blepharitis. Treatment and Causes. Eyelid inflammation | Patient”. Patient (на језику: енглески). Архивирано из оригинала 5. 12. 2015. г. Приступљено 31. 5. 2016.
- ^ Paton, Laura J.; Beauchemin, Karen A.; Veira, Douglas M.; von Keyserlingk, Marina A. G. (2006). „Use of sodium bicarbonate, offered free choice or blended into the ration, to reduce the risk of ruminal acidosis in cattle”. Canadian Journal of Animal Science. 86 (3): 429—437. doi:10.4141/A06-014 .
- ^ Brian Waple (19. 6. 2017). „Sodium Bicarbonate: The User-Friendly Blasting Abrasive”. Restoration & Remediation.
- ^ In the coronavirus-era, removing graffiti along public roadways is a low priority, Приступљено 2021-02-01.
- ^ „Blast Away Grime With Baking Soda”. Popular Mechanics. 5. 8. 2013. Приступљено 2. 8. 2020.
- ^ Housecroft, Catherine E.; Sharpe, Alan G. (2008). „Chapter 22: d-block metal chemistry: the first row elements”. Inorganic Chemistry, 3rd Edition. Pearson. стр. 716. ISBN 978-0-13-175553-6.
- ^ „Science Lab.com”. MSDS- Sodium carbonate. sciencelab.com. Архивирано из оригинала 5. 9. 2012. г.
- ^ а б „Finishing Techniques in Metalwork”. Philadelphia Museum of Art.
- ^ „Put a Shine on It”. scifun.chem.wisc.edu. Архивирано из оригинала 31. 7. 2012. г. Приступљено 6. 3. 2011.
- ^ Orcutt JA. „Depleted Uranium and Health: Facts and Helpful Suggestions”. Pharmacology and Toxicology of Uranium Compounds. McGraw-Hill. Архивирано из оригинала 17. 1. 2013. г. Приступљено 21. 3. 2012.
- ^ Raymond, Jessica (10. 6. 2016). „Kitchen Odor Eliminating Candles, Products, and Tricks”. cravedujour.com. Архивирано из оригинала 7. 8. 2020. г. Приступљено 29. 6. 2016.
- ^ Vicki Lansky, Martha Campbell, Baking Soda: Over 500 Fabulous, Fun, and Frugal Uses You've Probably Never Thought Of, 2009, ISBN 1931863733, p. 28
- ^ "A trusted solution for more than 170 years. Pure and simple.", Arm & Hammer "About Us" page
- ^ Keith Sawyer, 2017, ISBN 0465093582, „keep food tasting fresh”. Group Genius: The Creative Power of Collaboration.
- ^ Clayton M. Christensen, Scott Cook, Taddy Hall, Marketing Malpractice: The Cause and the Cure, Harvard Business Review, December 2005, [2]
- ^ "Myth #100: An Open Box of Baking Soda in the Fridge absorbs Odors", Bruce Weinstein, Mark Scarbrough, Lobsters Scream When You Boil Them; And 100 Other Myths About Food and Cooking, 2011, ISBN 1439195382, p. 312
- ^ „Baking Soda as Odor Absorber | Cook's Illustrated”. Cooksillustrated.com. Приступљено 28. 2. 2022.
- ^ а б Papuga, Aleksandra; Polańczyk, Andrzej (2023-12-06). „Analysis of the latest guidelines for the neutralization of selected acids, including recommendations for emergency responders”. Zeszyty Naukowe SGSP. 1 (88): 75—95. ISSN 0239-5223. doi:10.5604/01.3001.0054.1220 .
- ^ а б „Decomposition of Carbonates”. General Chemistry Online. Архивирано из оригинала 2. 10. 1999. г. Приступљено 16. 3. 2010.
- ^ Warr, L.N. (2021). „IMA–CNMNC approved mineral symbols”. Mineralogical Magazine. 85 (3): 291—320. Bibcode:2021MinM...85..291W. S2CID 235729616. doi:10.1180/mgm.2021.43 .
- ^ Warr, L.N. (2021). „IMA–CNMNC approved mineral symbols”. Mineralogical Magazine. 85 (3): 291—320. Bibcode:2021MinM...85..291W. S2CID 235729616. doi:10.1180/mgm.2021.43 .
- ^ Mindat
- ^ Webmineral data
- ^ Choi, C. S.; Mighell, A. D. (1. 11. 1982). „Neutron diffraction study of sodium sesquicarbonate dihydrate”. Acta Crystallographica Section B: Structural Crystallography and Crystal Chemistry. 38 (11): 2874—2876. doi:10.1107/S0567740882010164.
- ^ Markl, Gregor; Baumgartner, Lukas (2002). „PH changes in peralkaline late-magmatic fluids”. Contributions to Mineralogy and Petrology. 144 (3): 331—346. Bibcode:2002CoMP..144..331M. S2CID 128954565. doi:10.1007/s00410-002-0401-6.
- ^ „Nahcolite”. Encyclopedia Britannica (на језику: енглески). 2012. Приступљено 2024-06-02.
- ^ Bolen, Wallace P. (јануар 2024). Soda ash (PDF). U.S. Geological Survey. Архивирано из оригинала (PDF) 2024-03-04. г.
- ^ а б Johnson, Ronald C.; Mercier, Tracey J.; Brownfield, Michael E.; Pantea, Michael P.; Self (2020). An Assessment of In-Place Oil Shale Resources in the Green River Formation, Piceance Basin, Colorado. U.S. Geological Survey.
- ^ PubChem. „Sodium bicarbonate”. pubchem.ncbi.nlm.nih.gov (на језику: енглески). Приступљено 2021-05-16.
- ^ „Sodium bicarbonate (S300) batch numbering and shelf life statement – Solvay Chemicals, Inc.” (PDF). 31. 1. 2019.
- ^ „Re: Shelf Life – Sodium Bicarbonate (all grades) – Tronox Alkali Corporation” (PDF). 1. 4. 2015.
- ^ „Does Baking Soda Go Bad? How to Know If It's Still Good”. The Spruce Eats (на језику: енглески). Приступљено 2021-05-16.
- ^ Renate Gerner. Instruments and substances used in mummification. In: Renate Gerner, Rosemarie Drenkhahn (ed.): Mumie und Computer. A multidisciplinary research project in Hanover. Special exhibition of the Kestner Museum Hanover from September 26, 1991 to January 19, 1992. Kestner Museum, Hanover 1991, ISBN 3-924029-17-2, p. 28 f.
- ^ Franz Dornseiff: "The Greek words in German." Walter de Gruyter & Co, Berlin 1950, p. 44.
- ^ Friedrich Kluge, Alfred Götze (Philologist): Etymological Dictionary of the German Language. 20th edition, ed. by Walther Mitzka, De Gruyter, Berlin / New York 1967; Reprint (“21st unchanged edition”) ibid 1975, ISBN 3-11-005709-3, p. 504.
- ^ „Definition of SALERATUS”. www.merriam-webster.com (на језику: енглески). Приступљено 6. 12. 2020.
- ^ „Company History”. Church & Dwight Co. Архивирано из оригинала 16. 10. 2011. г.
- ^ Kipling, Rudyard (1897). Captains Courageous. стр. 25.
- ^ Bristow, Nancy K. (2012), American Pandemic: The Lost Worlds of the 1918 Influenza Epidemic, Oxford University Press, стр. 178, ISBN 978-0199811342
- ^ Thieme, Christian (2000). „Sodium Carbonates”. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. ISBN 3527306730. doi:10.1002/14356007.a24_299.
- ^ Holleman AF, Wiberg E (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 0-12-352651-5.
- ^ Page 45, section 3.6.2.1 of "Process Best Practices Reference Document (BREF) for Soda Ash," report produced by the European Soda Ash Producer's Association Архивирано 3 октобар 2006 на сајту Wayback Machine, March 2004.
- ^ „Duck Soup (1933)”. IMDb. Приступљено 4. 8. 2015.
- ^ „A Night at the Opera (1935)”. IMDb. Приступљено 4. 8. 2015.
Literatura
уреди- Haynes, William M., ур. (2011). CRC Handbook of Chemistry and Physics (92nd изд.). CRC Press. ISBN 978-1439855119.